Resumen
En el cáncer colorrectal metastásico (CCRm) se han producido en los últimos años notables progresos. Con la quimioterapia moderna y los biológicos anti-diana se ha aumentado la supervivencia global por encima de los 30 meses gracias a los tratamientos de primera, segunda y tercera línea. Además en los casos en que se puede integrar la cirugía de las metástasis el beneficio es aún mayor con algunos pacientes que obtienen largas supervivencias.
Hoy se dispone de numerosos factores pronóstico, y algunos factores predictivos. Entre los primeros están: la carga tumoral, el estado del paciente, la localización del tumor primario o el momento de aparición de las metástasis (tumor sincrónico o metacrónico).
Los factores predictivos están relacionados con alteraciones genómicas que pueden orientar a un tratamiento individualizado. Efectivamente la medicina de precisión ha dado lugar a tratamientos dirigidos en función de alteraciones moleculares en RAS, RAF, Her2, etc. El análisis de éstas alteraciones en el tejido, aunque imprescindible, es limitado ya que no informa de la heterogeneidad y la plasticidad de las células tumorales. Por tal motivo la biopsia líquida (analizando las CTC o el ctDNA) es una extraordinaria posibilidad para tener un fotograma a lo largo de la enfermedad que permite detectar nuevas mutaciones, y monitorizar la respuesta al tratamiento. Adicionalmente la inmunoterapia juega un extraordinario papel cuando existe inestabilidad de microsatélites (MSI) por alteraciones en la expresión de los genes reparadores del DNA.
Por último la integración de los datos procedentes de la genómica, y del resto de ómicas, junto a la información clínica representa una oportunidad única para el progreso en el tratamiento del CCRm.
Sin embargo y a pesar de todos estos avances muchos son los retos que tenemos por delante, por lo que se precisan nuevos estudios que utilizando todas las herramientas disponibles puedan mejorar los resultados actuales.
Abstract
In metastatic colorectal cancer (mCRC) there have been notably advances in recent years that have been changed their natural history. With modern chemotherapy and biological anti-target agents the overall survival has increased over 30 months thanks to the first, second and third line treatments, according to the concept of the continuum. In addition, in cases where the surgery of metastasis can be integrated, the benefit is even greater with some patients obtaining a long survival. To decide the best strategy, there are numerous prognostic factors and some predictive factors. Among the first ones are the data referring to the tumor load, the patient’s condition, the location of the primary tumor and the moment in which the metastasis is diagnosed (synchronous or metachronous tumor).
As predictive factors, the most interesting are related to genomic alterations that can guide an individualized treatment. Indeed, precision medicine has given rise to more specific and effective targeted treatments, oriented according to molecular alterations in RAS, RAF, Her2, etc. However, the analysis of these alterations in the tissue, although essential, is limited since it does not report the heterogeneity and plasticity of the tumor cells. For this reason, liquid biopsy (analyzing CTCs or ctDNA) is presented as an extraordinary possibility of having a photogram throughout the disease to detect new mutations, and monitor the response to treatment. Additionally, immunotherapy plays an extraordinary role in cases where there is microsatellite instability (MSI) due to alterations in the expression of DNA repair genes.
The integration of data from genomics, and the rest of omics, together with clinical information represent a unique opportunity for progress in the treatment of CCRm.
In summary, despite the progress made in the treatment of mCRC, there are numerous pending challenges, been necessary new studies using all the available tools in order to improve current results.
Palabras clave: Cáncer colo-rectal metastásico; Marcadores Moleculares; Medicina de Precisión; Biopsia Líquida.
Keywords: Metastatic colorectal cancer; Molecular Markers; Precision Medicine; Liquid Biopsy.
INTRODUCCIÓN
Desde la mitad del siglo pasado el tratamiento del cáncer colorrectal metastásico (CCRm) ha tenido una enorme evolución, gracias, a la incorporación de nuevos fármacos, un mejor diagnóstico de la enfermedad, una exquisita evaluación de la eficacia, mejores conocimientos de la biología tumoral, un enfoque multidisciplinario, desarrollo de plataformas moleculares y en definitiva un gran esfuerzo de investigación clínica.
Sin embargo a pesar del progreso que se ha realizado en el CCRm, con la introducción del moderno arsenal del tratamiento médico, la cirugía, las técnicas de terapia locoregional, el diagnóstico por la imagen, y la medicina de precisión, son numerosos los retos que aún quedan por delante. Es evidente que algunos pacientes pueden conseguir largas supervivencias e incluso la curación de la enfermedad, pero la mayoría sigue teniendo supervivencias que por media no sobrepasan los 30 meses.
Algunos aspectos históricos de relevancia
En 1957 Charles Heidelberg en la Universidad de Wisconsin descubrió el 5-Fluoruracilo, un fármaco que transformaría el escenario del tratamiento del CCRm. Su acción antimetabólica de incorporación al DNA y en parte al RNA hará que pronto empiece a utilizarse. De esa manera los trabajos de Charles Moertel en los años 60 del siglo pasado consiguen aumentar la supervivencia global (SG) del CCRm de una media de 5 meses a 9 meses. No obstante en aquel momento uno de los mayores problemas era cómo llevar a cabo una evaluación correcta de la eficacia de los fármacos; ya que de lo único que se disponía era de la exploración física manual o de una radiografía simple de abdomen. Sin embargo poco a poco la imagen cobra protagonismo con la aparición de las nuevas técnicas: la ecografía abdominal, la tomografía computarizada, la resonancia magnética y más recientemente el PET-TAC. En 1979 aparecen los criterios de evaluación de respuesta de la OMS, y más adelante en el año 2000 los RECIST, en el 2009 el RECIST 1.1, y el PERCIST y finalmente los irRECIST.
En 1960 este viejo roquero, el 5-Fluorouracilo, se utilizaba en monoquimioterapia, si bien rápidamente diferentes estudios de laboratorio pusieron de manifiesto que su acción citotóxica era mayor cuando había ambientes ricos de folatos lo que aumentaba la inhibición de la timidilato sintetasa, surgiendo así la modulación bioquímica con leucovorín. Un hecho del máximo interés es que la administración del 5-FU en forma de infusión continua le convertía en un fármaco con actividad y toxicidad diferente respecto a la forma “bolus”. Fue así como diversos grupos Europeos (entre ellos el español TTD) se lanzaron al desarrollo de esquemas de infusión continua que hoy en día han reemplazado a la forma “bolus”. Con estos cambios se llegaba en el CCRm a una tasa de respuesta (RR) del 20%, tiempo a la progresión (TTP) de 6 meses y SG de 12 meses. Aún así el CCRm era considerado como un tumor quimio-resistente.
En el año 2000 aparecen tres fármacos citotóxicos: el irinotecán, el oxaliplatino y una fluoropirimidina oral, la capecitabina. Los dos primeros presentaban sinergismos con el flurouracilo o con las fluoropirimidinas orales y así nacieron los regímenes tipo FOLFOX, FOLFIRI, IFL, XELOX y XELIRI (2,3). A partir de aquí el CCRm se consideró como quimiosensible, con RR del 50%, TTP de 8 meses, y SG de 20 m. Comenzaron además las segundas y terceras líneas.
Finalmente en el año 2004 entramos en la era biológica con la llegada de los agentes antidianas. Aparecen fármacos dirigidos frente el EGFR, como el Cetuximab y el Panitumumab, y antiangiogénicos como el Bevacizumab. La RR llega al 70%, el TTP a 12 meses y la SG a los 25 meses. Es la era de los biológicos y el CCRm se convierte así en un tumor bio-sensible.
Desde entonces hasta la actualidad han aparecido nuevos antiangiogénicos como el Aflibercept y el Regorafenib y recientemente un antimetabolito como el TAS-102. De esta manera se ha llegado a la conclusión que los pacientes que más se benefician son los que reciben más líneas de tratamiento, desarrollándose la idea del continuo del tratamiento donde se intercalan tratamientos de mantenimiento e incluso periodos de descansos. Actualmente la SG media global del CCRm en el año 2018 se sitúa en los 30 meses, lo que ha sido demostrado en grandes estudios como el CALGB, PRIME, FIRE-3, PEAK, y los de mantenimiento como el MACRO, AIO 0207, y el CAIRO 3 (2,3).
Los dogmas y los paradigmas están para romperlos
Clásicamente se ha considerado que el tratamiento de la enfermedad metastásica es la quimioterapia y que la cirugía tiene para estos casos un papel poco relevante. Sin embargo a partir del año 2000 comienzan a aparecer excelentes trabajos demostrando que en aquellos pacientes que solo existen metástasis hepáticas, y cuando éstas son técnicamente resecables, los pacientes pueden conseguir una cirugía R0 y con ello largas supervivencias (1). Más aún, enfermos cuyos tumores de entrada no eran resecados podían llegar a serlo gracias a una quimioterapia previa de conversión o de reducción. Este concepto revolucionario ha cambiado drásticamente el panorama de los pacientes con CCRm, lo que ha sido contemplado en las sucesivas guías de ESMO (2) y en las de la NCCN (3).
Otro dogma en revisión se refiere a los tumores sincrónicos que tienen “d´amblé” metástasis y presencia de tumor primario. Aunque la práctica habitual es que estos pacientes sean tratados con quimioterapia para control de las metástasis y que el tumor primario solo sea extirpado en caso de generar problemas locales, diferentes estudios retrospectivos indican que la cirugía del primario de entrada podría ser beneficiosa en términos de aumento de la supervivencia global (4). Los motivos podrían estar relacionados con la prevención de las complicaciones, el poder practicar una cirugía reglada, y en disminuir la influencia del tumor primario sobre el crecimiento de las células tumorales en las metástasis, inhibiendo además la vascularización. Aunque se necesitan estudios prospectivos no cabe duda de que la tendencia parece estar cambiando.
Un tercer paradigma en revisión es la localización del tumor primario en la enfermedad metastásica, ya que los estudios del CALGB 8045, FIRE-3, PRIME, PEAK, CRYSTAL, etc, han puesto de manifiesto que los tumores de colon izquierdo tienen mejor pronóstico y que responden más optimamente a los anti-EGFR que los del colon derecho (5), (6), (7), (8) (3). Más aún hoy sabemos que embriológicamente el colon derecho y el izquierdo pueden considerarse como dos órganos diferentes, que carcinogénicamente los tumores son distintos y que su fisiopatología no es la misma. Todo ello da lugar al alteraciones moleculares diferentes que conforman tumores con características distintas. Pero es que además en los casos en que la alteración molecular es la misma, el pronóstico y supervivencia global es mejor para el lado izquierdo con respuestas a los biológicos diferentes. De hecho para los tumores RAS WT del lado izquierdo el tratamiento de elección serían los anti-EGFR, mientras que en lado derecho se aconsejarían los antiangiogénicos (reservando los anti-EGFR solo cuando se buscan respuestas). En cuanto al cáncer de recto, se comporta exactamente como el lado izquierdo, si bien puede tener características moleculares diferentes (9).
Con este escenario es preciso acometer nuevas acciones que cambien la historia de la enfermedad de un tumor que sigue teniendo una enorme letalidad. A nuestro juicio estas acciones serían las siguientes:
MEJOR UTILIZACIÓN DE FÁRMACOS Y ESTRATEGIAS
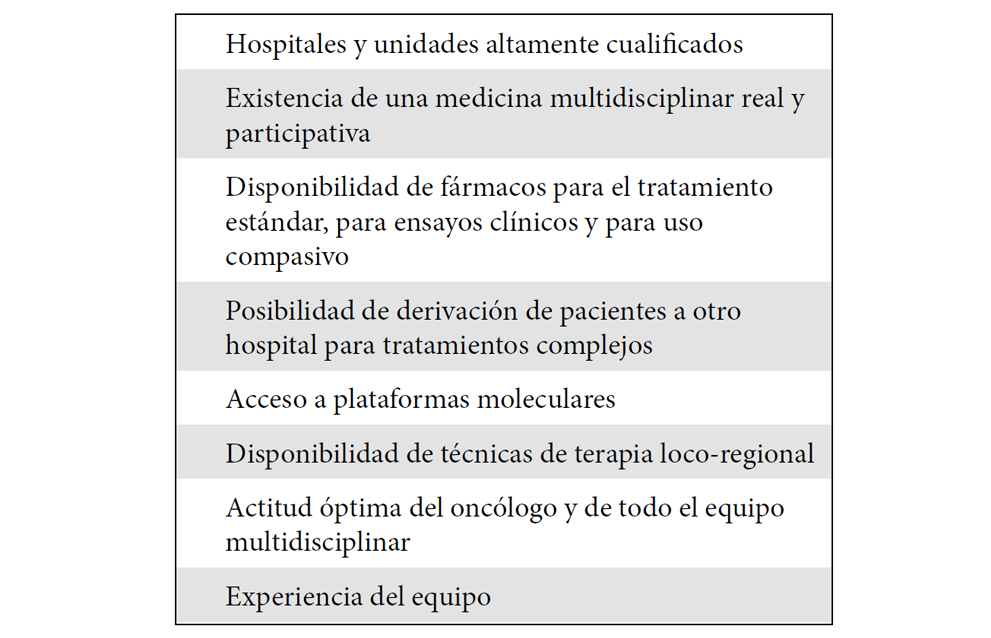
Integrar las distintas estrategias en el tratamiento del CCRm no es fácil. De acuerdo a las guías de ESMO 2016 (2) lo más importante es definir la intención del tratamiento, de modo que se puedan separar aquellos pacientes en los que el objetivo es llevar a cabo una cirugía de las metástasis de los que en ningún caso eso es posible y por tanto lo más importante es el control de la enfermedad. No es el objetivo entrar aquí en la descripción de los distintos pacientes que pueden presentarse, y cuales son las mejores oportunidades terapéuticas, pero sí al menos vale la pena señalar que más allá de las guías clínicas existen una serie de requisitos que nos parecen básicos para garantizar a los pacientes el mejor tratamiento posible (Tabla 1)
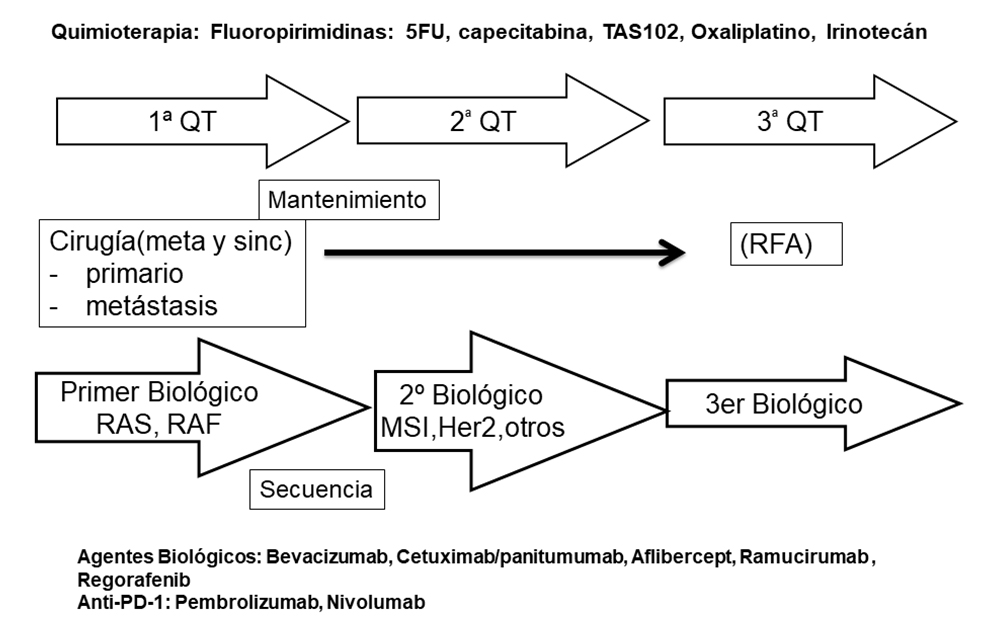
El tratamiento del CCRm incluye los fármacos quimioterápicos (5-fluoruracilo, capecitabina, TAS 102, oxaliplatino e irinotecán) utilizados de manera apropiada de acuerdo al continuo del tratamiento y administrados sucesivamente en primera, segunda, tercera e incluso cuarta línea. Las combinaciones quimioterápicas más importantes son el FOLFOX, FOLFIRI, y XELOX y la utilización de uno u otro depende de la intención del tratamiento, de las características del paciente, y de la respuesta obtenida en el continuo del tratamiento. Una interesante posibilidad es utilizar tratamientos de mantenimiento con la menor quimioterapia posible, cuando entendemos que se ha obtenido la máxima respuesta posible. El tipo del biológico a utilizar en cada momento (anti-EGFR: cetuximab y panitumumab; o antiangiogénico: bevacizumab, aflibercept, regorafenib) dependerá de la existencia de mutaciones o no del RAS y del RAF, así como de la línea de tratamiento. Cuando hay alteración de microsatélites (MSI) los fármacos más apropiados son los inmunoterápicos (pembrolizumab y nivolumab) y la presencia de otras alteraciones como HER2 sugiere que el mejor tratamiento es con fármacos anti-HER2 (figura 1).
Más allá de estos requisitos básicos, si queremos cambiar la historia natural del CCR metastásico, debemos reorientar nuestros conceptos. Efectivamente desde 2004 hasta la actualidad se ha conseguido aumentar la SG de los pacientes, pero sin embargo no hemos logrado modificar la supervivencia libre de progresión (SLP). Lo anterior quiere decir que el efecto terapéutico conseguido lo ha sido en gran medida debido a la utilización de sucesivas líneas terapéuticas: 1ª, 2ª, 3ª, líneas etc; pero no tanto por un aumento de la SLP tras la primera línea. Si se quiere cambiar este último concepto, la SLP, es preciso que le demos valor a criterios como la respuesta temprana (ETS) o la profundidad de la respuesta (DpR) diseñando estudios dirigidos a contestar estas preguntas. Los criterios RECIST de valoración de la respuesta habitualmente utilizados, miden la respuesta antitumoral en dos visitas consecutivas, pero no tiene en cuenta la rapidez en que pueda producirse, la profundidad o la duración. Los criterios de ETS y DpR han sido analizados en detalle (10) (11) (12) (13) y muestran que los pacientes que más se benefician de los tratamientos son los que tienen una respuesta temprana y además una mayor profundidad de respuesta. Estos criterios deberían ser introducidos en los ensayos clínicos, con el objeto de aumentar la SLP y en definitiva tener una SG más consistente. Lo anterior tiene especial relevancia para conocer los pacientes que pueden tener un mayor beneficio de la integración de la cirugía de metástasis.
Por otro lado el tema de la secuenciación sigue sin responderse. No sabemos cual es la mejor primera línea, ni tampoco la segunda o la tercera línea. A pesar de los grandes esfuerzos realizados a través de los estudios PEAK (14) (15), FIRE3 (16) o CALGB 8045 (17), la estrategia terapéutica en pacientes RAS WT sigue siendo un desafío. Saber si es mejor comenzar con un anti-EGFR o un antiangiogénico precisa de estudios bien diseñados como el “Sequence” del TTD (pacientes RASWT de lado izquierdo), en el que esté bien establecida la secuencia a seguir marcando con precisión la primera línea (FOLFOX panitumumab vs FOLFOX bevacizumab) y la segunda línea (FOLFIRI bevacizumab y FOLFIRI panitumumab).
En todo caso precisamos incorporar nuevos fármacos, especialmente en aquellos pacientes con un peor pronóstico, como por ejemplo los que presentan mutaciones en BRAF. Para estos casos la historia nos demuestra que la estrategia de un gen, un fármaco no es real en CCRm, ya que se producen escapes en las vías de señalización que generan resistencia. Por lo tanto dos o mejor tres fármacos parece más realista. En este aspecto habrá que esperar a los ensayos fase III en marcha para contestar a estas preguntas.
IMPLEMENTACIÓN DE LA MEDICINA DE PRECISIÓN
Los estudios moleculares llevados a cabo por el grupo de Volgestein (18), del “Cancer Genome Atlas Network” (19), y del Grupo de Consenso de la Clasificación Molecular (20), han puesto de manifiesto la importancia de las alteraciones genómicas en el CCR, tanto en relación a la carcinogénesis, como a su papel pronóstico y predictivo para determinadas terapias. La medicina de precisión es un concepto que deriva de la medicina molecular y que se refiere a que una vez hecha la caracterización del genoma tumoral y por tanto identificadas las alteraciones moleculares, los pacientes deberían ser tratados en función de ellas (21); ya en ensayos clínicos o bien en el contexto de la medicina clínica si existen fármacos dirigidos accionables.
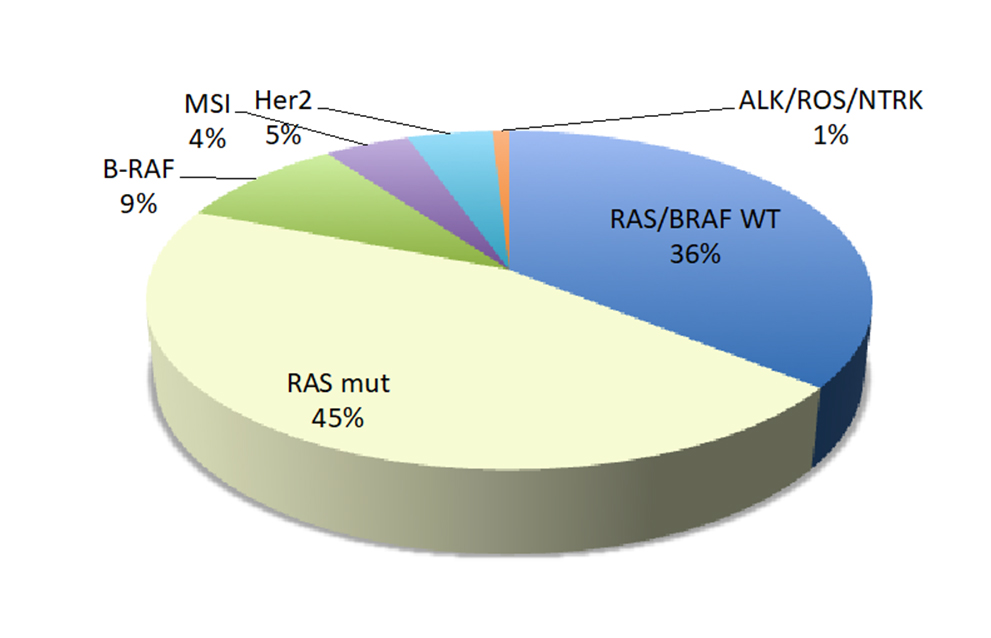
En el año 2008 se estableció de manera fehaciente que los pacientes con CCRm que tenían una mutación del gen KRAS en el exón 2 (codón 12 y 13) no deberían recibir un tratamiento con un anti-EGFR, y más recientemente en 2013 tras los estudios PRIME y CRYSTAL esta situación se ha extendido a los exones 2, 3 y 4 del KRAS, así como a estos mismos exones en el NRAS (22). Todo ello suma alrededor de un 60% de pacientes con mutaciones resistentes al anti-EGFR. Adicionalmente un 8-10% presentan mutaciones en BRAF (V600E) lo que les confiere un peor pronóstico y resistencia a los tratamientos anti-EGFR, aunque su papel predictivo no ha podido ser demostrado taxativamente. Más allá de RAS y BRAF otras mutaciones han sido descritas; como las amplificaciones (20%) de MET y HER2, mutaciones en EGFR y mutaciones /alteraciones en PI3KCA, HER3 y PTEN. Estas alteraciones moleculares pueden presentarse de novo o adquirirse tras un tratamiento con un anti-EGFR, salvo la mutación en EGFR que es claramente adquirida (23) (24) (25) (26) (figura 2).
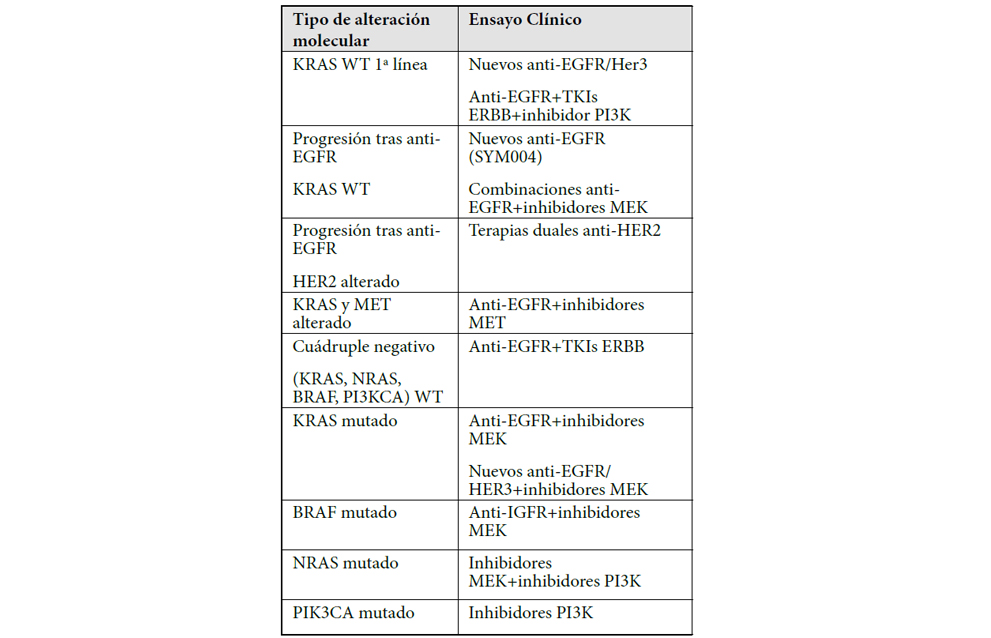
Todo lo anterior ha dado lugar a una serie de ensayos clínicos (fase I-II) diseñados en función de las alteraciones moleculares existentes y cuyos resultados se esperan para dentro de poco. En la tabla 2 se exponen algunos de los ensayos en marcha.
Hay varios ejemplos de estudios con éxito en el campo de la medicina de precisión. El estudio Heracles (27) se llevó a cabo en pacientes que tenían en sus tumores mutaciones o sobreexpresiones del HER2, utilizándo dos fármacos anti-HER2 (Trastuzumab y Lapatinib), aumentando la tasa de respuestas y la SG en pacientes con mal pronóstico que habían progresado a quimioterapia, Bevacizumab o anti-EGFR.
También existen datos de enorme interés en pacientes con BRAF mutado. El estudio TRIBE que combinó un triplete quimioterápico (FOLFOXIRI) con Bevacizumab (28), al igual que el ensayo SWOG S1406 utilizando la combinación de Vemurafenib (inhibidor de BRAF) con Cetuximab e Irininotecán (29), produjeron una llamativa tasa de respuestas. Interesantemente (30) los pacientes con BRAF mutado que son tratados con 3 fármacos tienen una mayor SLP y tasa de respuestas que si reciben monoterapia con fármacos anti-BRAF o dobletes (anti-BRAF + anti-EGFR). En este sentido es muy importante el estudio en marcha denominado BEACON (31) que está evaluando en pacientes BRAF mutados (que han recibido 1-2 líneas previas de tratamiento) la combinación de un triplete con un anti-BRAF (Encorafenib), un anti-MEK (Binimetinib) y un anti-EGFR (Cetuximab), frente a una rama con un doblete (anti-BRAF + Cetuximab) y frente a una rama control con quimioterapia más un anti-EGFR.
Por último no olvidemos que aunque raros, hay tumores que tienen una alteración en el gen de fusión NTRK, y que para estos casos ya han sido aprobados por la FDA fármacos específicos como el entrectinib o larotrectinib.
Con todo ello cabe preguntarse si no deberíamos utilizar, en el momento del diagnóstico del CCRm, un panel de genes que incluyera al menos todos aquellos genes para los que puede haber un tratamiento dirigido. No debemos olvidar que hoy existen plataformas NGS muy potentes (como Foundation One) que son capaces de analizar mutaciones en más de 300 genes, reordenamientos genéticos, estudio de MSI e incluso conocer la carga tumoral mutacional. Son sin duda tecnologías que en la medida en que vayamos teniendo más dianas accionables con fármacos, se van a hacer más necesarias y que se convertirán en unos años de obligada utilización en la clínica del día a día
La nueva Clasificación Molecular:
A partir del año 2012 diversos grupos han tratado de llevar a cabo una clasificación molecular del CCR atendiendo a diversos criterios según la vía molecular alterada (inestabilidad de microsatélites, RAS, RAF, vía Wnt) y de acuerdo al comportamiento del estroma (mesenquimal, inmune, etc). Esta necesidad está determinada en tanto que el CCR es un enfermedad muy heterogénea y dinámica lo que se traduce en una incertidumbre pronostica y en una gran diversidad de casos en relación a la respuesta a los tratamientos. Estas clasificaciones moleculares están basadas en la expresión génica estudiada a través de “microarrays”, pero en modo alguno han sido uniformes, lo que ha sido motivo de la creación de un consorcio internacional para intentar unificarlas y que finalmente a través de la utilización de datos en gran escala y mediante un modelo matemático “markovniano” ha dado sus frutos (20). De esta manera se ha podido clasificar al CCR en 4 grupos que en esencia se exponen en la tabla 3.
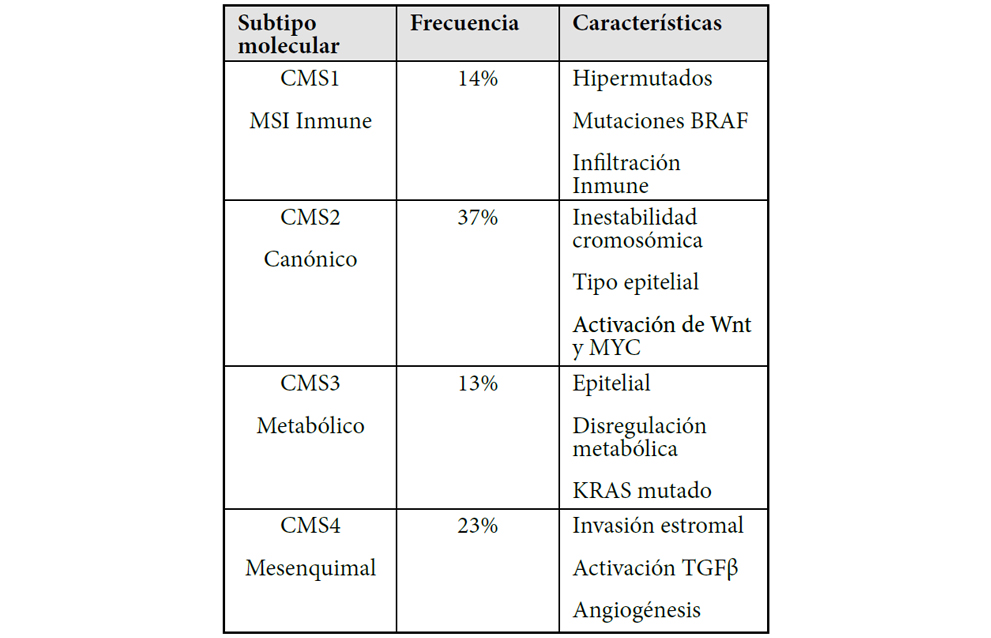
Esta clasificación molecular tiene una gran importancia no solo para el mejor conocimiento del CCR, sino además por que informan sobre el pronóstico y por cuanto identifica alteraciones moleculares o patogénicas que son enormemente útiles para plantear tratamientos dirigidos en ensayos clínicos.
Una nueva arma: la Inmunoterapia:
No es de extrañar que ASCO a través de la revista “Journal Clinical Oncology” haya nominado a la inmunoterapia como el mayor avance del año 2015, 2016 y 2017 (32) (33) (34) gracias al desarrollo de los inhibidores de los “checkpoints” (anti-CTLA4 y los anti-PD1 y anti-PDL1). Estos fármacos han cambiado la historia natural de distintos tumores como el melanoma, cáncer de pulmón, tumores uroteliales, cáncer de cabeza y cuello, tumores hematológicos, etc.
Entre sus logros cabe destacar el trabajo seminal llevado a cabo en tumores hipermutados (con MSI), fundamentalmente en CCRm (35). Aunque es un fase II con un número muy limitado de pacientes que recibieron Pembrolizumab (anti-PD1) tras más de dos líneas de tratamiento, los resultados han sido muy llamativos respecto a la tasa de respuesta, la SLP y la SG. Es preciso añadir que los tumores con MSI representan solo el 4-8% de todos los CCRm y que frecuentemente tienen mutaciones en BRAF siendo su pronostico muy malo. Estos resultados con un anti-PD1 son muy brillantes y han sido confirmados con el estudio CheckMate-142 utilizando Nivolumab solo o combinado con Ipilimumab (36).
Todo ello pone de manifiesto que los tumores con MMRD estimulan el sistema inmune al tener una mayor carga de neoantígenos y que los anti-PD1 levantan el freno inmune consiguiendo una importante respuesta antitumoral.
Especialmente interesante es la asociación de determinados subtipos de la clasificación molecular de consenso con la respuesta a agentes inmunoterápicos. Así los tumores CMS1 son considerados como altamente inmunogénicos, mientras que el resto son inmunotolerantes (CMS 2, 3 y 4). Para el primer caso, levantar el freno inmunológico utilizando inhibidores de “checkpoints” cuando hay MSI, es sin duda la mejor opción. Para los segundos es preciso conocer en más profundidad el motivo de la tolerancia. Efectivamente no es lo mismo que ésta sea debida a una mayor actividad del TGFb a que lo sea por un motivo estromal o mesenquimal. Recientes estudios utilizando inhibidores del TGB para los CMS 2 y 3 son altamente alentadores (37). También son esperanzadores para estos subgrupos los recientes ensayos con la aspirina capaz de potenciar la acción de los anti-PD1 (38).
LA BIOPSIA LÍQUIDA. EL TNMB
La biopsia líquida no solo permite el estudio de las alteraciones moleculares sino que además atiende a cuestiones muy importantes como son la heterogeneidad tumoral y el dinamismo de los tumores que obedecen a un modelo darwiniano evolutivo.
Mediante las tecnologías modernas la biopsia líquida permite estudiar las células tumorales circulantes (CTC) y el DNA tumoral circulante (ctDNA). El análisis de las CTC ha mostrado su interés para el pronóstico del CCRm, pero no su papel como factor predictivo. Esto unido al hecho de que el 50% de los pacientes con CCRm no expresan CTC ha provocado que en la práctica clínica no se utilice su determinación. El estudio “VISNÚ” del grupo TTD que estratifica los pacientes en función del número de CTC puede aportar luz en este sentido. Por otro lado las nuevas tecnologías permiten una mejor numeración de CTC y además un análisis genómico del DNA, del RNA y de las proteínas, así como el cultivo de las CTC. Sin duda es una tecnología que tendrá mucho que aportar en el futuro (39) (40).
En cuanto a la determinación del ctDNA en plasma, ésta se ha mostrado fiable en el 100% de los casos con CCRm (41). Lo anterior permite estudiar las mutaciones de RAS y de otros genes (tanto las alteraciones de “novo” como las adquiridas), y además hacerlo con seguridad y fiabilidad cuantas veces sea necesario (42). Por lo tanto puede servir para monitorizar la respuesta y para conocer el desarrollo de resistencias como la S492R del EGFR. Por otro lado el concepto de la selección tumoral bajo presión terapéutica, y la desaparición de la mutación de resistencia tras un periodo de cambio de tratamiento, abre la puerta a la reintroducción de fármacos (“rechallenge”). Numerosos estudios en marcha harán de esta tecnología uno de los campos más prometedores de la personalización terapéutica. Concretamente los datos en enfermedad localizada son impresionantes en cuanto al valor pronóstico del ctDNA (43).
No cabe duda de que las técnicas actuales para analizar alteraciones moleculares tienen una enorme precisión, siendo algunas de ellas capaces de detectar fracciones alélicas mutadas (MAF) de hasta el 0.01%, lo que plantea la problemática de conocer cual es el porcentaje mínimo necesario para llevar a cabo la indicación de una determinada terapéutica. En cualquier caso es preciso subrayar que la correspondencia entre la determinación de las mutaciones de RAS en tejido y plasma es de alrededor el 90%, por lo que su implementación en la clínica no debería constituir un problema (44) (45) (46) (47).
Evidentemente la biopsia de tejido sigue siendo esencial ya que nos informa de las características histológicas, inmunohistoquímicas y moleculares del tumor; si bien tiene la limitación de hacerlo de un solo lugar y en un momento determinado. Una foto fija. La biopsia liquida nos da un fotograma completo, que permite construir la película evolutiva del tumor, ofreciendo información real de la carga tumoral, análisis de las alteraciones moleculares en distintos momentos de la enfermedad, datos de los diferentes clones, y existencia de nuevas mutaciones y de genes de resistencia. Su importancia es tal que ya se ha propuesto la transformación del clásico TNM en el TNMB, donde la biopsia líquida sería imprescindible (48). En definitiva la biopsia líquida es un complemento extraordinario a la biopsia de tejido.
INTEGRACIÓN DE TODA LA INFORMACIÓN
Integrar los datos de la genómica, epigenómica, transcriptómica, estromales, y clínicos, es sin duda un gran reto para el CCRm (49). La relación que existe entre estos aspectos es muy fuerte, y también lo suficiente diferente como para que la suma de la información nos permita un tratamiento más individualizado. Por otro lado los estudios FIRE-3 y CALGB 8045 ponen de manifiesto que la clasificación molecular de consenso también se puede aplicar al CCRm y no solo a los tumores localizados. Por todo ello en el futuro será preciso que los ensayos clínicos aborden este problema.
A continuación se expone un intento por nuestra parte de un algoritmo basado en el momento de la aparición de las metástasis en relación al tumor primario, la localización y los aspectos moleculares (figura 3).
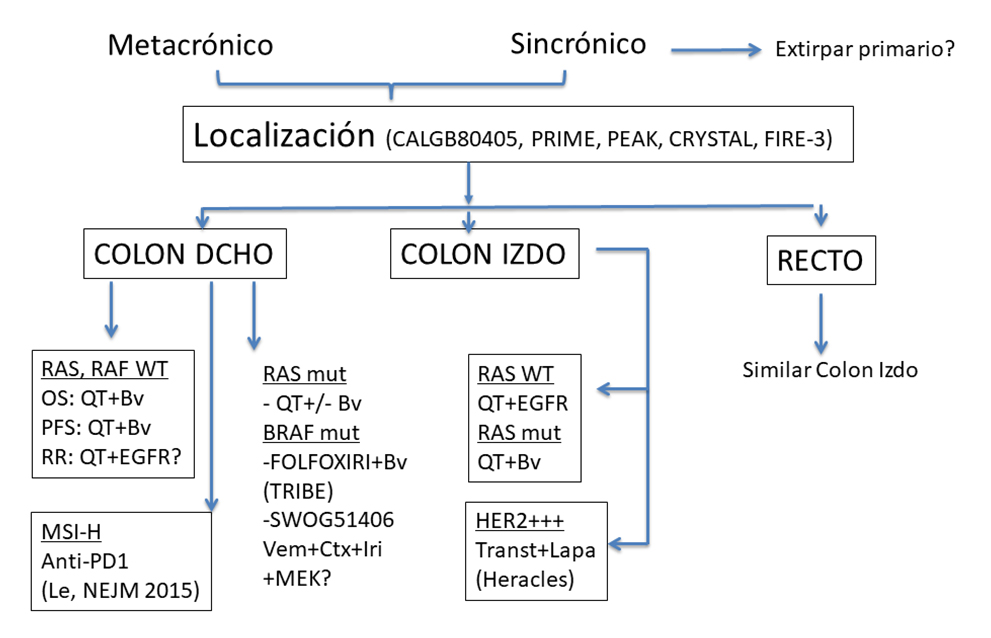
En conclusión, que a pesar de los progresos realizados en el cáncer colorrectal metastásico aún siguen siendo enormes los retos que tenemos por delante. Las respuestas a esta necesidad tiene que venir de la mano del análisis de las alteraciones moleculares, el desarrollo de fármacos accionables, y el estudio de la heterogeneidad y de la plasticidad de las células tumorales a través de la biopsia líquida.
CONCLUSIONES
Se precisan nuevos estudios que utilizando las oportunidades que nos ofrecen las herramientas actuales puedan mejorar los resultados de la supervivencia.
BIBLIOGRAFÍA
- Adam R, De Gramont, Figueras J et al.- The oncosurgery approach to managing liver metastasis from colorectal cancer: a multidisciplinary international consensus. Oncologist 2012; 17: 1225-1239.
- Van Cutsem E; Cervantes A; Adam R et al.- ESMO consensus guidelines for the management of patients with metastatic colorectal cáncer. Ann Oncol 2016: 27 (8): 1386-1422.
- Clinical Practice Guidelines in Oncology (NCCN Guidelines). Colon Cancer. Version 1. 2018. www.nccn.org
- Van Rooijen KL, Shi Q, Goey KKH et al.- Prognostic value of primary tumour resection in synchronous metastatic colorectal cancer: Individual patient data analysis of first-line randomised trials from the ARCAD database. Eur J Cancer 2018, 91: 99-106.
- Petrelli F, Tomasello G, Borgonovo K et al.- Prognostic survival associated with left-sided vs rigth-sided colon cancer: A systematic review and meta-analysis. Jama Oncol 2017, 3: 211-219.
- Holch JW, Ricard I, Stintzing S, Modest DP and Heineman V.- The relevance of primary tumour location in patients with metastatic colorectal cancer: A meta-analysis of first-line clinical trials. Eur J Cancer 2016; 70: 87-98.
- Moretto R, Cremolini C, Rossini D et al.- Location of primary tumor and benefit from anti-epidermal growth factor receptor monoclonal antibodies in patients with RAS and BRAF wild-type metastatic colorectal cancer. Oncologist 2016; 21: 988-994.
- Tejpar S, Stinzing S, Ciardello F et al.- Prognostic and predictive relevance of primary tumor location in patients with RAS wild-type metastatic colorectal cancer. Retrospective analyses of the CRYSTAL and FIRE-3 trials. Jama Oncol 2017; 3(2):194-201.
- Salem M, Yin Y, Renfro LA et al.- Rectal versus left-sided colon cancers: clinicopathological differences observed in a pooled analysis of 4.182 patients enrolled to 8 clinical trials from the ARCAD database. J Clin Oncol 2017, 35, no 4, suppl, 675.
- Taieb J, Rivera F, Siena S et al.- Exploratory analyses assesing the impact of early tumour shrinkage and depth of response on survival outcomes in patients with RAS wild-type metastatic colorectal cancer receiving treatment in three randomised panitumumab trials. J Cancer Res Clin Oncol 2018, 144: 321-335.
- Douillard JY, Siena S, Peeters M et al.- Impact of early tumour shrinkage and resection outcomes in patients with wild-type RAS metastatic colorectal cancer. Eur J Cancer 2015; 51: 1231-1242.
- Heinemann V, Rivera F, O´Neil BH et al.- A study-level meta-analysis of efficacy data from head-to head first-line trials of epidermal growth factor receptor inhibitors vs bevacizumab in patients with RAS wild-type metastatic colorectal cancer. Eur J Cancer 2016, 67: 11-20.
- Cremolini C, Loupakis F, Antoniotti C et al.- Early tumor shrinkage and depth of response predict long-term outcome in metastatic colorectal cancer patients treated with first-line chemotherapy plus bevacizumab: results from phase III TRIBE trial by the Gruppo Oncologico del Nord Ovest. Ann Oncol 2015; 26: 1188-1194.
- Schwartzberg LS, Rivera F, Karthaus M et al.- PEAK: a randomized multicenter phase II study of panitumumab plus modified fluorouracil, leucovorin, and oxaliplatin (mFOLFOX6) or bevacizumab plus mFOLFOX6 in patients with previously untreated, unresectable wild-type KRAS exón 2 metastatic colorectal cancer. J Clin Oncol 2014; 32: 2240-2247.
- Rivera F, Karthaus M, Helcht JR et al.- Final analysis of the randomised PEAK trial: overall survival and tumour responses during first-lie treament with mFOLFOX6 plus either panitumumab or bevacizumab in patients with metastatic colorectal carcinoma. Int J Colorectal Di 2017; 32: 1179-1190.
- Heineman V, Von Weikersthal LF, Decker T et al.- FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial. Lancet Oncol 2014; 15: 1065-1075.
- Venouk AP, Niedzwiecki D, Lenz HJ, et al.- CALGB/SWOG 80405: Phase III trial of irinotecan, 5-FU/leucovorin (FOLFIRI) or oxaliplatin, 5-FU/leucovorin (mFOLFOX6) with bevacizumab (BV) or cetuximab (CET) for patients (pts) with KRAS wild-type (wt) untreated metastatic adenocarcinoma of the colon or rectum (MCRC). J Clin Oncol 2014; 32:5s (suppl; abstr LBA3).
- Fearon ER, Volgestein B.- A genetic model for colorectal tumorigenesis. Cell 1990; 61: 759-767.
- Comprehensive molecular characterization of human colon and rectal cancer. The Cancer Genome Atlas Net work. Nature 2012; 487: 330-337.
- Guinney J, Dienstmann R, Wang B et al.- The consensus molecular subtypes of colorectal cáncer. Nature Med 2015; 21: 1350-1356.
- Garraway LA.- Genomic-driven oncology: Framework for an emerging paradigm. J Clin Oncol 2013; 31, 1806-1814.
- Sorich MJ, Wiese MD, Rowland A et al.- Extended RAS mutations and anti-EGFR monoclonal antibody survival benefit in metastatic colorectal cancer: a meta-analysis of randomized controlled trials. Ann Oncol 2015; 26: 13-21.
- Sinicrope F; Okamoto K, Kasi P and Kawakami H.- Molecular biomarkers in the personalized treatment of colorectal cancer. Clin Gastroenterol Hepatol 2016; 14: 651-658.
- Choi C, Al Bakir I, Hart A and Graham T.- Clonal evolution of colorectal cancer in IBD.- Nature Rev Gastroenterol Hepatol. 2017; 14: 218-229.
- Punt CA; Koopman M and Vermeulen L.- From tumour heterogeneity to advances in precisión treatment of colorectal cancer. Nat Rev Clin Oncol 2017; 14: 235-246.
- Atreya C, Yaeger R, and Chu E.- Systemic therapy of metastatic colorectal cancer: From current standars to future molecular targeted approaches. ASCO Educational Book 2017; 246-256.
- Sartore-Bianchi A, Trusolino L, Martino C et al.- Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codón 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicenter, open-label, phase 2 trial. Lancet Oncol 2016; 17: 738-746.
- Cremolini C, Loupakis E, Antoniotti C et al.- FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of metastatic colorectal cancer: Updated survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol 2015; 16: 1306-1315.
- Kopetz S, Mac Donough SL, Morris VK et al.- Randomized trial of irinotecan and cetuximab with or without vemurafenib in BRAF-mutant metastatic colorectal cancer (SWOG 1406). J Clin Oncol 2017;35, suppl 4S, abst 520.
- Sanz-García E, Argiles G, Elez E, Tabernero J.- BRAF mutant colorectal cancer: prognosis, treatment and new perspectives. 2017;Ann Oncol 28: 2648-2657.
- Van Cutsem E, Cuyle PJ, Huijberts S et al.- BEACON CRC study safety lead-in (SLI) in patients with BRAFV600E metastatic colorectal cancer: Efficacy and tumor markers. J Clin Oncol 2018; 36, suppl 4S, abs 627.
- Dizon DS, Krilov L, Cohen E et al.- Clinical Cancer Advances 2016: Annual Report on Progress Against Cancer From the American Society of Clinical Oncology. J Clin Oncol 2016; 34: 987-1011.
- Burstein HJ, Krilov L, Aragon-Ching JB.- Clinical Cancer Advances 2017: Annual Report on Progress Against Cancer From the American Society of Clinical Oncology. J Clin Oncol 2017;35: 1341-1367.
- Heymach J; Krilov L; Alberg A et al.- Clinical Cancer Advances 2018: Annual Report on Progress Against Cancer from the American Cancer Society of Clinical Oncology. J Clin Oncol 2018; 36: 1020-1044.
- Le DT, Uram JN, Wang UH et al.- PD-1 Blockade in tumors with mismatch-repair deficiency. N Engl J Med 2015; 372: 2509-2520.
- Overman M, Lonardi S, Wong KY et al.- Durable clinical benefit with Nivolumab Plus Ipilimumab in DNA mismatch repair-deficient microsatellite instability high metastatic colorectal cancer. J Clin Oncol 2018;36: 773-779.
- Tauriello D, Palomo-Ponce S, Stork D et al.- TGFB drives immune evasión in genetically reconstituted colon cancer metástasis. 2018; Nature 554, 538-543.
- Hamada T, Cao Y, Quian Z et al.- Aspirin use and colorectal cancer survival according to tumor CD274 (Programmed Cell Death 1 Ligand 1) expression status. J Clin Oncol 2017; 35: 1836-1844.
- Díaz LA and Bardelli A.- Liquid Biopsies: Genotyping circulating tumor DNA. J Clin Oncol 2014; 32: 579-586.
- Siravegna G, Marsoni S, Siena S and Bardelli A.- Integrating liquid biopsies into the management of cancer. Nat Rev Clin Oncol 2017;14: 531-548.
- Bettegowda C; Sausen M; Leary et al.- Detection of circulating tumor DNA in early and late stage human malignancies. Sci Transl Med 2014; 6 (224): 224ra24.
- Garcia-Foncillas J, Alba E, Aranda E, et al.- Incorporating BEAMing technology as a liquid biopsy into clinical practice for the management of colorectal cancer patients: an expert taskforce review. Ann Oncol 2017;28 (12): 2943-2949.
- Tie J, Wang Y, Tomasetti C et al.- Circulating DNA analysis detects minimal residual disease and predicts recurrence in patients with stage II colon cáncer.Science Transl Med 2016; 346, 1-10.
- Schmiegel W, Scott RJ, Dooley S et al.- Blood-based detection of RAS mutations to guide anti-EGFR therapy in colorectal cancer patients: concordance of results from circulating tumor DNA and tissue-based RAS testing. Mol Oncol 2017; 11 (2): 209-219.
- Normanno N, Esposito R, Lambiase M et al.- RAS testing of liquid biopsy correlates with the outcome of metastatic colorectal cancer patients treated with first-line FOLFIRI plus cetuximab in the CAPRI-GOIM trial. Ann Oncol 2017;29: 112-118.
- Grasselli J, Elez E, Caratú G et al.- Concordance of blood- and tumor-based detection of RAS mutations to guide anti-EGFR therapy in metastatic colorectal cancer. Ann Oncol 2017;28 (6): 1294-130.
- Vivancos A, Aranda E, Benavides et al.- Evaluation of the sensitivity of RAS mutation detection of the Idylla platform in comparison to the OncoBEAM™ RAS CRC assay. Abs 592. ASCO GI 2018.
- Yang M, Forbes ME, Bitting RL et al.- Incorporating blood-based liquid biopsy information into cancer staging: time for a TNMB system? Ann Oncol 2018; 29: 311-323.
- Dienstmann R, Vermoulen L, Guinney J, Kopetz S, Tejpar S, Tabernero J.- Consensus molecular subtypes and the evolution of precisión medicine in colorectal cancer. Nat Rev Cancer J 2017; 17: 79-92.
DECLARACIÓN DE TRANSPARENCIA
El autor declara ser consultor o participante en Advisory Boards de las siguientes compañías farmacéuticas y/o empresas de tecnología biomédica: Merck-Serono, Amgen, Bayer, Genómica, Servier.
El autor declara su actividad como conferenciante en simposios o reuniones organizados por las situientes compañías farmacéuticas y/o empresas de tecnología biomédica: Servier, MSD, Amgen.
El autor declara el uso de fondos de investigación procedentes de las siguientes compañías farmacéuticas y/o empresas de tecnología biomédica donde se realiza la investigación: Roche, Merck-Serono, Amgen, Astra-Zéneca.
Eduardo Díaz-Rubio
Real Academia Nacional de Medicina de España
C/ Arrieta, 12 · 28013 Madrid
Tlf.: +34 91 159 47 34 | Email de correspondencia
Año 2018 · número 135 (02) · páginas 160 a 168
Enviado*:05.06.18
Revisado: 16.06.18
Aceptado: 15.07.18
* Fecha de lectura en la RANM


