Resumen
La incidencia de la insuficiencia cardiaca aumenta a pesar de disponer actualmente de tratamientos farmacológicos más eficaces, de dispositivos de resincronización cardiaca, desfibriladores implantables y de otros procedimientos quirúrgicos que mejoran la sintomatología y prolongan la supervivencia en fases iniciales de esta cardiopatía (1). Sin embargo, resultan ineficaces en fases más avanzadas de la enfermedad, donde solo los dispositivos de asistencia mecánica circulatoria y el trasplante cardiaco han demostrado su capacidad para prolongar la supervivencia y mejorar la calidad de vida en este complejo grupo de pacientes (2).
Abstract
Cardiac insuffiency incidency increases despite of having more efficient pharmacological treatments at the time present, cardiac resynchronization devices, implanted desfibrillators and other chirurgical procedures that improve sintomatology and prolong survival in the inicial states of this cardiopaty (1).Nevertheless, they remain inefficient in more advanced phases of the disease where only mechanical circulatory support devices and heart transplantation have proved capable of prolonging survival and improving life quality in this complex group of patients (2).
Palabras clave: Insuficiencia cardiaca refractaria; Asistencia mecánica circulatoria; Ventrículos artificiales; Flujo axial; Asistencia definitiva.
Keywords: Refractory cardiac Insufficiency; mechanical Circulatory support; Artificial ventricles; Axial flow; Destination therapy.
Este artículo constituye la prolongación de otro anteriormente publicado en los Anales de la Real Academia Nacional de Medicina de España nº 135 (01), titulado también Asistencia Mecánica Circulatoria, pero referido más específicamente a las bombas centrífugas: de rodillo, rotatorias, axiales y centrífugas magnéticas (3).
ANTECEDENTES HISTÓRICOS
Los dispositivos de asistencia ventricular se emplearon inicialmente en situaciones de insuficiencia cardiaca tras cardiotomía en la década de los 70 del siglo XX. En 1978 se utilizó por primera vez una asistencia ventricular como puente al trasplante y en la década de los 80, la FDA (Food and Drug Administration), en EEUU aprobó las asistencias ventriculares como apoyo circulatorio en pacientes con insuficiencia cardiaca avanzada, utilizándose en 1984 el primer dispositivo a largo plazo como puente al trasplante cardiaco. En 1996, tras explantar con éxito una asistencia ventricular a un paciente cuya función cardiaca había mejorado sustancialmente, el concepto de soporte como puente a la recuperación se convirtió en objetivo alcanzable para algunos pacientes (4). En 2001 el estudio REMATCH (Randomiced Evaluation of Mechanical Assistence for the Treatment of Congestive Heart Failure) (5) confirmó que las asistencias ventriculares podían servir como tratamiento permanente (terapia de destino) en pacientes con insuficiencia cardiaca terminal refractaria a un tratamiento médico convencional.
Las asistencias ventriculares se utilizan para apoyar la función del ventrículo izquierdo (LVAD), aunque también pueden dar soporte al ventrículo derecho (RVAD) o a ambos, asistencia biventricular ( BiVAD) (6).
Indicaciones
- Shock cardiogénico post infarto agudo de miocardio.
- Disfunción miocárdica tras cirugía cardiaca.
- Insuficiencia cardiaca secundaria a miocarditis.
- Insuficiencia cardiaca crónica descompensada.
- Puente al trasplante, a la decisión, a la recuperación o como terapia de destino.
Tipos de dispositivos
En relación con la ubicación del dispositivo:
- Extracorpóreos
- Intracorpóreos
Según el ventrículo asistido:
- Univentricular
- Biventricular
- Corazón artificial total.
Según el tipo de flujo:
- Flujo pulsátil (primera generación)
- Flujo continuo (segunda y tercera generación)
Según la duración de la asistencia:
- Clase I: a corto plazo
- Clase II: a medio plazo
- Clase III: a largo plazo o como terapia de destino.
A. Dispositivos de Clase I
Los dispositivos de flujo continuo (8) carecen de válvulas, tienen menos riesgo de tromboembolismo y buena tolerancia a largo plazo. En una anterior presentación ya comentada (3) describíamos distintos tipos de bombas, como la de rodillos (similar a la circulación extracorpórea) y las bombas centrífugas, como los dispositivos de Clase I.
B. Dispositivos de Clase II
Dispositivos extracorpóreos
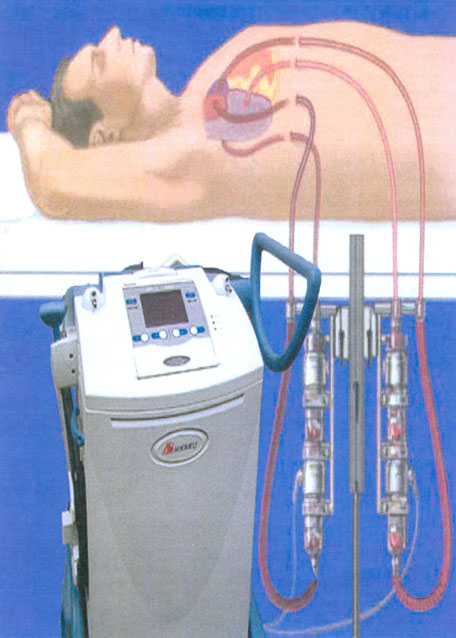
Abiomed BVS 5000 (Abiomed INC) (FIG. 1)
Se trata de un soporte mecánico externo, aprobado por la FDA en 1993, para su utilización como puente al trasplante o como asistencia postcardiotomía. Proporciona un flujo pulsátil de hasta 6 litros por minuto. Posee válvulas de poliuretano y permite un soporte uni o biventricular. Entre sus ventajas destaca su facilidad de uso y disponibilidad en múltiples centros cardioquirúgicos. Como desventajas podríamos destacar la tromboembolia, hemorragias e infecciones que impiden su utilización más allá de 14 días.
Berlin Heart Excor (MEDIPORT) (FIG. 2)
Posee diferentes tamaños (10 a 80 ml) lo que permite su utilización tanto en neonatos como en adultos. Fue uno de los primeros dispositivos que incluyeron bombas paracorpóreas miniaturizadas. Las superficies de poliuretano están revestidas de heparina. En el modelo neonatal los requerimientos energéticos son grandes, ya que tienen que vencer grandes resistencias dado el pequeño tamaño de las cánulas.

Existe experiencia en su utilización tanto como puente al trasplante o a la recuperación.
Thoratec VAD (FIG. 3)
Es una asistencia ventricular extracorpórea (7) con flujo pulsátil neumático, que permite soporte uni o biventricular, proporcionando flujo de hasta 7 litros por minuto.
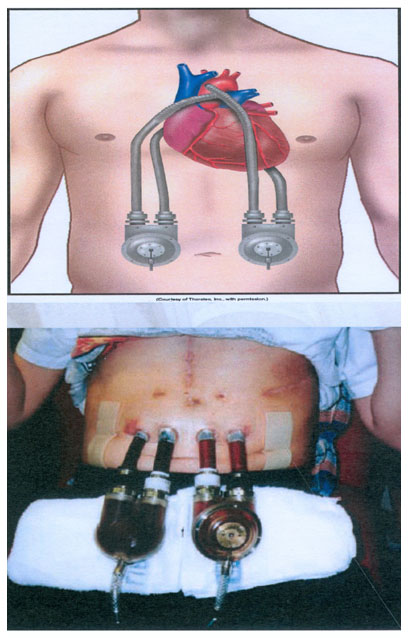
Para la asistencia al ventrículo izquierdo la cánula de entrada se puede localizar en el ápex de dicho ventrículo o en la aurícula izquierda. La cánula de salida se conecta a la aorta ascendente. Para la asistencia al ventrículo derecho, la cánula de entrada se coloca en la aurícula o más excepcionalmente en ventrículo derecho. La cánula de salida se conecta con la arteria pulmonar.
La bomba externa, donde se encuentra la sangre, dispone de dos válvulas metálicas monodisco tipo Bjork-Shiley y de una consola externa para gobernar el dispositivo.
Suele utilizarse como puente al trasplante o en la recuperación e incluso como terapia de destino a largo plazo. Requiere anticoagulación sistémica durante todo el tiempo que permanece implantado el dispositivo.
Existe una versión miniaturizada, llamada Thoratec IVAD que permite asistencia uni o biventricular de larga duración. Dado el reducido tamaño, el sistema de bomba se puede colocar en la pared abdominal, facilitando una mejor movilidad, permitiendo que el paciente pueda ser trasladado a su domicilio.
C. Dispositivos de Clase III
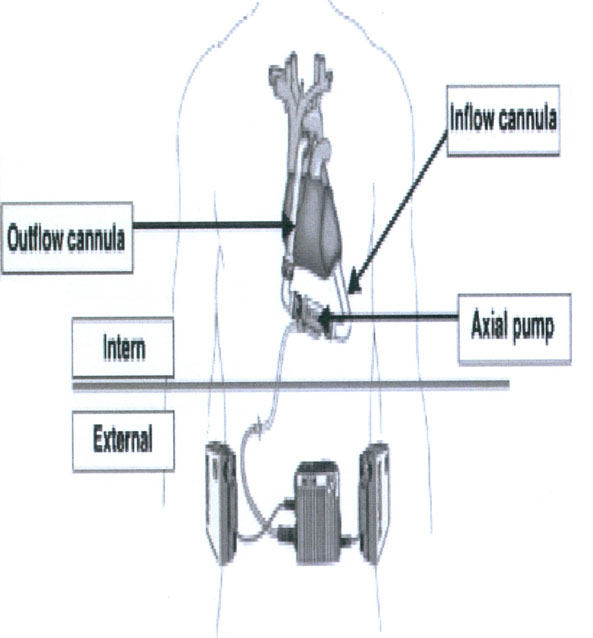
Dispositivos intracorpóreos para asistencia ventricular izquierda
Los progresos en los sistemas de asistencia circulatoria (8) han permitido fabricar dispositivos intracorpóreos para soporte de ventrículo izquierdo, implantables en el abdomen, que se conectan con el exterior mediante una línea de comunicación. Estas bombas eléctricas de flujo pulsátil se diseñaron para utilización prolongada. Permiten la movilización del paciente, su deambulación e incluso el alta hospitalaria.
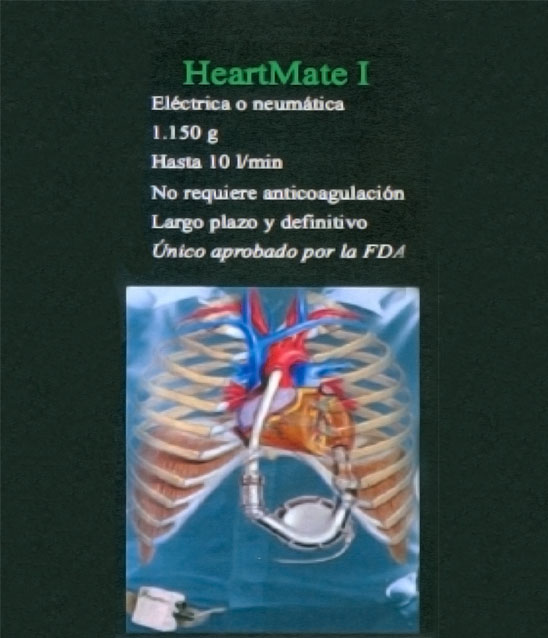
HeartMate (Thoratec Corporation) (FIG. 4)
Esta familia de dispositivos ha ido evolucionando con los años. El primer dispositivo, HeartMate IP, fue inicialmente neumático. Se alimentaba y controlaba desde una consola externa portátil, de funcionamiento neumático. Fue objeto de discusión la aparatosidad y gran volumen de estas consolas. Necesariamente estas maquinarias debían ser voluminosas porque la FDA exigía doble mecanismo de conducción del corazón a cada consola, e incluso en ocasiones llevaban incorporado un comprensor extra o un tanque de aire comprimido como medida de seguridad en caso de fallo del soporte energético.
HeartMate VE, HeartMate XVE (FIG. 5)
La HeartMate VE, sustituida posteriormente por HeartMate XVE, son dispositivos electrónicos. Esta última fue aprobada como puente al trasplante desde el año 2001y como terapia de destino desde el 2003 tras el estudio REMATCH. Las superficies internas de las cámaras tienen un revestimiento de microesferas de titanio que facilitan la formación de una pseudointima o pseudoendotelización lo que disminuye la trombogenicidad y la infección, evitándose la necesidad de anticoagulación permanente. Actualmente constituye uno de los sistemas más empleados globalmente.

Novacor (World Heart Corporation) (FIG. 6)
Es un dispositivo parcialmente implantable que permite una asistencia circulatoria a largo plazo. Se inició su aplicación en 1984. El sistema consiste en una bomba de sangre que actúa electromecánicamente y en un generador de energía externo.

La superficie de contacto con la sangre es un saco de poliuretano que se deforma simétricamente mediante electroimanes. Consta de válvulas porcinas y proporciona un flujo de hasta 8,5 litros por minuto. La bomba se coloca en el abdomen y un cable conecta con el exterior. El conducto de entrada está situado en el ápex del ventrículo izquierdo y el conducto de salida se conecta a la aorta ascendente. Tiene una autonomía de hasta 7 horas. Entre sus desventajas podemos citar, además de su tamaño, un 5%-7% de tromboembolismo.
LionHeart (Arrow International) (FIG. 7)
Es el primer dispositivo de asistencia ventricular izquierda diseñado exclusivamente como terapia de destino. Todos sus componentes (bomba, cánulas de entrada y de salida, controlador del motor, cámara de compliance y sistema transcutáneo de trasmisión de energía) son implantables. Constan de una válvula mecánica monodisco y tiene una autonomía de una hora.

Otros dispositivos:
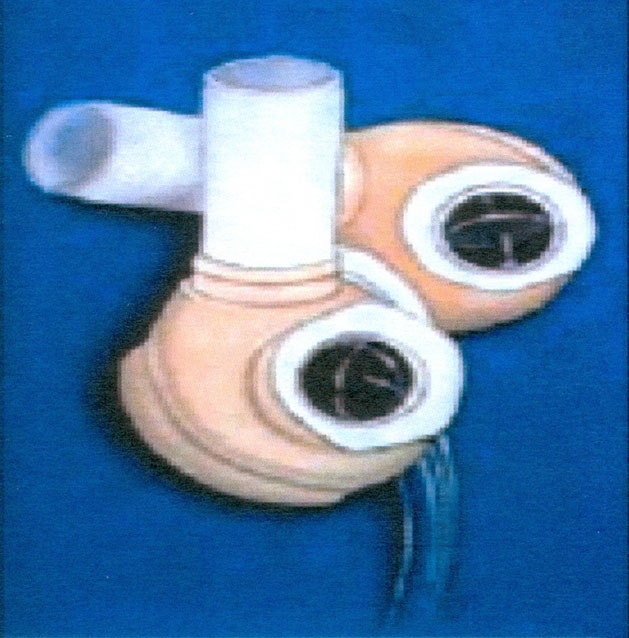
Corazón artificial total JARVIK-7 (FIG. 8)
A semejanza de la mayoría de los corazones artificiales totales implantables, en una primera fase de su desarrollo constaba de dos bombas similares a los ventrículos neumáticos utilizados en otros sistemas de asistencia circulatoria. Dispone de una carcasa rígida donde está contenido un saco de poliuretano. La expulsión de la sangre se consigue mediante el aumento de la presión del aire que ocupa el espacio entre la carcasa rígida y el saco de poliuretano.
Suelen disponer de dispositivos de conexión rápida del corazón a las aurículas y a los grandes vasos. Disponen de prótesis valvulares tipo Bjork-Shiley para encauzar unidireccionalmente el sentido del flujo sanguíneo. Unas líneas de conducción percutáneas conectan las bombas con la consola o unidad de conducción del aparato.
Cuando en el dispositivo los ventrículos artificiales no están en posición ortotópica intratorácica sino que son paracorpóreos, externos (Fig.8) el sistema recibe el nombre de Symbion, aunque todos sus componentes son idénticos al Jarvik-7.
Cardiowest (Syncardia) (FIG. 9)
Se trata de un dispositivo idéntico al Jarvik-7 que empezó a implantarse por DeVries en Utah, Hospital Humana, como implante permanente. Debido a las complicaciones detectadas, la FDA denegó su utilización con esta modalidad de asistencia definitiva, autorizándola exclusivamente como puente al trasplante cardiaco. En 1985, Copeland en la Universidad de Arizona (10) reinició con autorización de la FDA, tras algunas pequeñas modificaciones y con un nuevo nombre comercial la versión modernizada de Jarvik-7, ahora denominado Cardiowest.
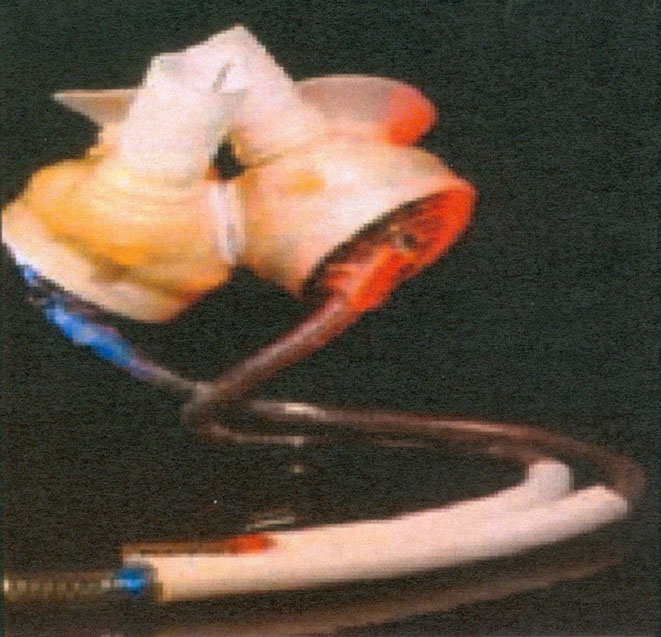
Es un corazón artificial total implantado en posición ortotópica. Ambas cámaras ventriculares, de poliuretano, se anastomosan a las aurículas nativas y los conductos de salida a los grandes vasos, aorta y arteria pulmonar, confeccionados con tejido de dacron. Cada cámara tiene dos válvulas mecánicas, tipo Bjork-Shiley y dispone de una consola externa para el manejo del dispositivo. Necesita anticoagulación y antiagregación plaquetaria. Se utiliza como puente al trasplante en casos de insuficiencia biventricular.
Bombas rotatorias:
Micromed DeBakey (Micromed Tecnology Inc.) (Fig. 10)
Es el primer dispositivo de asistencia ventricular de este tipo utilizado clínicamente. Permite un flujo de hasta 10 litros/m, alcanzando 1.000 revoluciones por minuto. Se monitoriza mediante un sensor ultrasonográfico ubicado en la salida de la bomba. El resto de componentes (baterías, consola de control) están situados exteriormente.

Se utiliza como terapia a largo plazo o bien como terapia de destino.
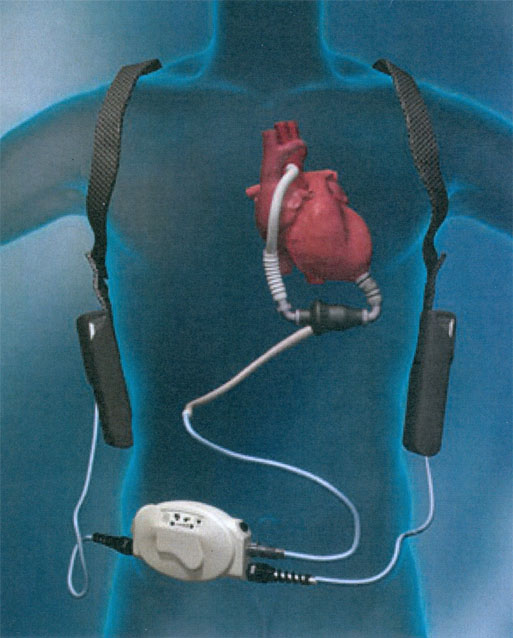
HeartMate II (Fig. 11)
Se implanta en un bolsillo preperitoneal, anterior a la vaina posterior del músculo recto abdominal, debajo del margen costal izquierdo. La cánula de entrada se sitúa en el apex del ventrículo izquierdo y la cánula de salida se conecta con la aorta ascendente. Existen dos tipos: neumáticos (consola externa) y eléctrico, con el motor dentro de la bomba. Utiliza válvulas porcinas y la superficie de contacto con la sangre está recubierta con una capa de pseudoíntima, lo que reduce la capacidad de generar tromboembolismo. Entre sus desventajas están su gran tamaño, la implantación se hace difícil si la superficie corporal es pequeña. Hay aparición de hemorragias y en el 20%-30% de los casos aparece insuficiencia cardiaca derecha existiendo también el riesgo de infecciones. Pero a pesar de estos inconvenientes (11) se está empezando a utilizar en España con buenos resultados como terapia de destino.
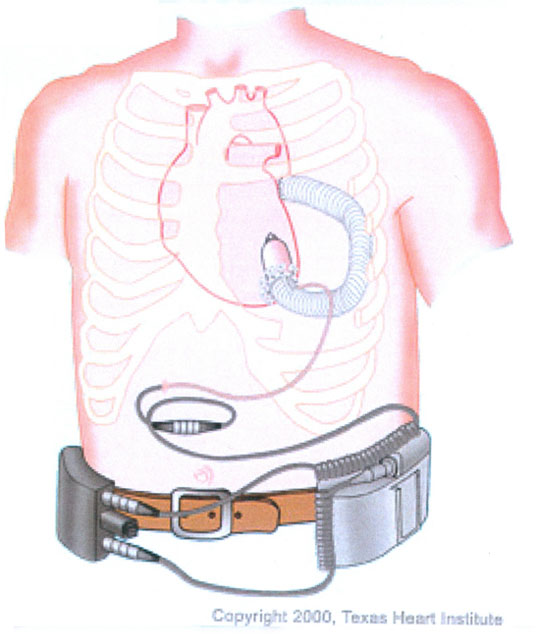
Incor (Fig. 12)
Este dispositivo eléctrico empezó a utilizarse el año 2002. El rotor está impulsado por levitación magnética, permitiendo un flujo de 3 a 10 litros por minuto. Está indicado como puente al trasplante o como terapia de destino.
Jarvik 2000 ( Jarvik Heart Inc )(Fig. 13)
Este dispositivo ha sido aprobado por la FDA desde el año 2000 como puente al trasplante (9) pero no como terapia de destino. La bomba, de 2,5 por 5,5 cm, proporciona un flujo de hasta 6 l/min, alcanzando hasta 1.200 revoluciones. El cuerpo de la bomba se inserta en el apex del ventrículo izquierdo conectándose mediante un conducto de dacron a la aorta descendente. La única parte móvil es el rotor. Dispone de un cable percutáneo que va desde la batería hasta el dispositivo dotado de un sensor de frecuencia cardiaca para responder en función de la misma.
Otras bombas rotatorias de levitación magnética:
DuraHeart. 180 ml / 540 gramos /72 x45 mm.
VentraAsist. 298gr/121ml/ 60 mm. Utilizada como puente al trasplante, a la recuperación o definitiva en más de 100 pacientes.
Levacor. 440 gr, diseñada para terapia definitiva.
Bombas centrífugas de tercera generación (12):
Anteriormente descritas en una presentación previa (3), la resumimos nuevamente.
HeartWare HVAD. Es una minicentrífuga de flujo continuo y de pequeño tamaño que se implanta directamente en el ventrículo izquierdo y se aloja en el espacio pericárdico, alcanzando un flujo máximo de 10l/m. Tienen un mecanismo híbrido hidráulico-magnético, por lo que se consigue que se reduzca la hemolisis. Ha sido utilizado como puente al trasplante cardiaco.
COMENTARIOS
Durante la última década se ha desarrollado una creciente experiencia con dispositivos más eficientes para la asistencia ventricular izquierda, comercialmente disponibles (estudio ADVANCE) pero se necesita disponer de más experiencia para conocer su durabilidad y funcionamiento a largo plazo (13, 14).
El talón de Aquiles de estos dispositivos radica en la posible aparición de alteraciones hematológicas y de infección tanto a nivel del dispositivo intracorpóreo como a nivel de la piel en el punto de salida de los cables que conectan el dispositivo interno con la fuente de energía externa. En un estudio sobre el dispositivo HeartWare los puntos de aparición de trombosis podían localizarse a tres niveles: en el interior del ventrículo izquierdo, dentro del propio dispositivo y finalmente en la aorta ascendente en el punto de implantación de la prótesis tubular que conecta el dispositivo con la circulación general.
¿Qué nos deparará el futuro?
Además de intervenciones quirúrgicas menos agresivas con técnicas mini – invasoras, sustituyendo la tradicional esternotomia media por dos minitoracotomias, la mejoría en los sistemas de asistencia circulatoria ya comentados en este trabajo, el avance tecnológico que ha supuesto la sustitución de flujo pulsátil por el flujo continuo, existiendo la posibilidad de utilizar bombas centrífugas más perfeccionadas (Fig.14) (HeartWare HVDA, DuraHeart, HeartMate 3) o bien dispositivos de flujo axial (INCOR, HeartMate II, HeartWare MVAD) (Fig.15), menor tamaño de los dispositivos, sistema de control y baterías más reducidas pero más eficientes, y, fundamentalmente, la transferencia de energía transcutánea e inalámbrica, que evitará la conexión a través de la piel del dispositivo con la fuente de energía, desapareciendo las infecciones a nivel del punto de salida del mecanismo de la bomba intracorpórea con la fuente de energía externa.
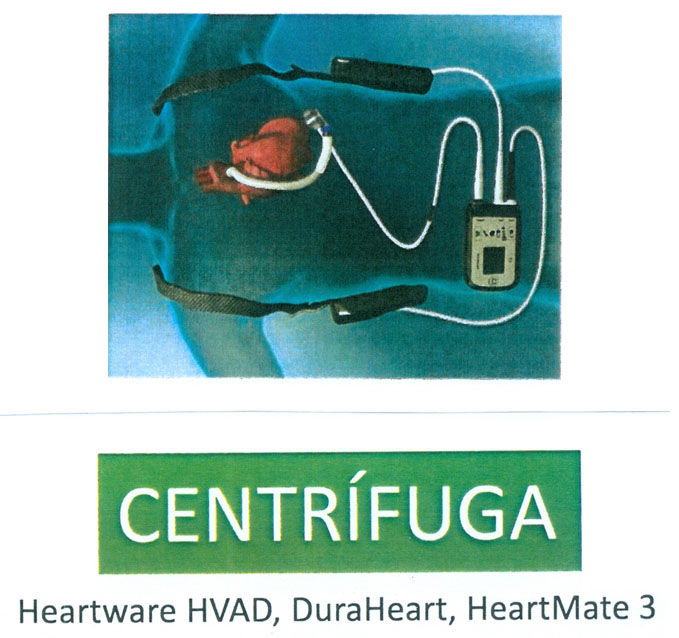
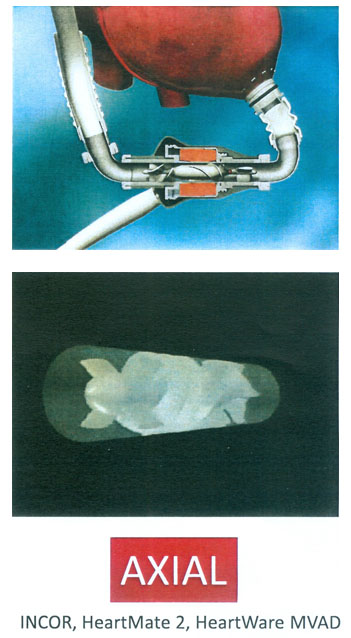
CONCLUSIONES
Podemos, por tanto, finalizar con las siguientes conclusiones:
- El cambio de flujo pulsatil a flujo continuo ha mejorado significativamente los resultados.
- A menor tamaño del dispositivo, será probablemente más fácil la anticoagulación.
- Los mejores resultados con la asistencia mecánica circulatoria como terapia de destino se obtiene en pacientes no críticos (Intermacs 7 a 3) (15).
- La supervivencia, calidad de vida y complicaciones empiezan a ser comparables con los resultados obtenidos con el trasplante cardiaco.
- Dada la escasez de donaciones de órganos y debido al aumento del número de pacientes en insuficiencia cardiaca, puede afirmarse que la terapia de destino con los nuevos dispositivos de asistencia mecánica circulatoria de flujo continuo se ha desarrollado hasta un nivel que podría considerarse como una alternativa real en ciertos pacientes candidatos a trasplante cardiaco.
AGRADECIMIENTOS
A los doctores Evaristo Castedo y Raúl Burgos por su contribución a parte de la iconografía.
BIBLIOGRAFÍA
- Mosterd A, Hoes AW, De Bruyne MC et al. Prevalence of heart failure and left ventricular dysfunction in the general population. Eur Heart J 1999; 20:447-455.
- Gómez Bueno M, Segovia Cubero J, Alonso-Pulpón Ribera L. Asistencia mecánica circulatoria y trasplante cardiaco : Indicaciones y situación en España. Rev Esp Cardiol Supl 2006; 6:82 F-84 F.
- Téllez de Peralta G. Asistencia Mecánica Circulatoria. Anales RANM 2018; 135 (01):31-39.
- Maybaum S, Kamalakaunan G, Murthys S. Cardiac recovery during mechanical assist device support. Semin Thoracic Cardiov Surgery 2008; 20: 234 -246.
- Rose EA, Gelings AC, Moskowitz AJ et al. Randomized evaluation of mechanical assistence for the treatment of congestive heart failure (REMATCH STUDY GROUP) : Long-term use of a mechanical left ventricular assist device for end-stage heart failure. N Engl J Med 2001; 345:1435-1443.
- Williams MR, Oz MC. Indications and patient selection for mechanical ventricular assistence. Ann Thorac Surg 2001; 71(3 suppl): 86-91.
- Goldstein DJ, Oz MC, editors. Cardiac assist devices. Armonk, New York: Futura; 2000.
- Patel CR, Cooper JA, Zukerman A. A contemporary review of mechanical circulatory support. J Heart Lung Transplant 2014; 33: 667-674.
- Frazier OH, Myers TJ, Westaby S, Gregorie ID. Clinical experiencie with an implantable, intracardiac, continuous flow circulatory support device: Physiologic implications and their relationaship to patient selection. Ann Thorac Surg 2004; 77: 132-142.
- Copeland J, Arabia F, Smith R, Nolan P. Intracorporeal support: The cardiowest total artificial heart. En: Goldstem DJ, Oz MC, editors. Cardiac assist devices. Armonk, New York: Futura; 2000: 341-355.
- Lietz K, Miller L. Destination terapy: Current results and future promise. Semin Thor Cardiovasc Surg 2008; 20: 225-233.
- Miller LW, Pagani FD, Russel SD et al. Use of a continuous-flow device in patients awaiting heart transplantation. N Engl J Med 2007; 357: 885-896.
- Feldman D, Pamboukclan SV, Tenteberg JJ, Birks E, Lietz K, Moore SA. The 2013 International Society for Heart and Lung Transplantation : Guidelines for mechanical circulatory support: executive sumary. J Heart Lung Transplant 2013; 32: 157-187.
- Slaughter M, Sing R. El papel de los dispositivos de asistencia ventricular en la insuficiencia cardiaca avanzada. Rev. Esp. Cardiol 2012; 65:982-985.
- Castedo E, Martínez Cabeza P, Pérez de la Sota E et al. Primer informe oficial de ESPAMACS: 369 dispositivos de Asistencia Mecánica Circulatoria : octubre 2014-mayo 2016. Cir Cardiov 2016 23(S1): 15-21.
DECLARACIÓN DE TRANSPARENCIA
El autor/a de este artículo declara no tener ningún tipo de conflicto de intereses respecto a lo expuesto en la presente revisión.
ranm tv
Gabriel Téllez de Peralta
Real Academia Nacional de Medicina de España
C/ Arrieta, 12 · 28013 Madrid
Tlf.: +34 91 159 47 34 | Email de correspondencia
Año 2019 · número 136 (02) · páginas 158 a 166
Enviado*: 21.05.19
Revisado: 28.05.19
Aceptado: 18.06.19
* Fecha de lectura en la RANM


