Resumen
La osteoporosis puede ser una complicación importante del trasplante de órganos (TxO), que puede llevar a menor calidad de vida y mayor riesgo de fracturas. El objetivo ha sido revisar el estado actual de este riesgo, en base a nuestra experiencia en relación, a la fisiopatología y tratamiento.
Después del TxO, los esteroides son el agente más nocivo sobre el remodelado óseo, con pérdida ósea importante en los primeros meses y una tendencia posterior a la recuperación en algunos, pero a persistir en otros. Junto a los esteroides, la ciclosporina y otros inmunosupresores, pueden contribuir al deterioro del remodelado óseo.
El tratamiento actual, es objeto de estudios y ensayos clínicos, siendo los bisfosfonatos los agentes más utilizados. De entre ellos hay más experiencia con el alendronato, risedronato y últimamente con el ácido zolendronico. Su eficacia es similar, y los efectos secundarios deben vigilarse durante su administración. Finalmente, la administración de calcio y vitamina D es recomendable, dado el frecuente déficit de esta vitamina en estos pacientes acentuada por los esteroides.Abstract
Osteoporosis can become a severe potential complication of organ transplantation, (OTx) that can lead to a greater risk for fractures and lower quality of life. The purpose has been to review state of this subject, taking in account our experience, in relation to the pathophysiology and therapy of postransplanted patients.
After OTx, glucocorticoids are the more deleterious agents on bone remodeling, which is particularly important in the first six months postransplantation, with a tendency in some to some recovery after, but that persist in others. Cyclosporine and other immunosuppressors associated to steroids, can contribute to the deterioration of bone remodeling.
Treatment is being subject to different studies and clinical trials, being bisphosphonates the agents more widely used. Alendronate, risedronate, and zolendronic acid, have a similar efficiency, but bone adverse effects should be observed during their administration. Finally, calcium and vitamin D, administration is recommended, given the frequent deficit of this vitamin, increased by steroids.Palabras clave: Trasplante de órganos; Inmunosupresión; Densidad Mineral Ósea; Glucocorticoides; Fracturas óseas.
Keywords: Organ Transplantation; Immunosuppression; Bone Mineral Density; Glucocorticoids; Bone Fractures.
INTRODUCCIÓN
En los últimos años, el trasplante de órganos (TxO) se ha convertido en una opción terapéutica que ha llevado a prolongar y salvar la vida de muchos pacientes con patologías terminales. Ello se ha debido, a la mejora de la técnicas quirúrgicas, a la utilización de métodos adecuados para la preservación de los órganos, y también a introducción de la inmunosupresión, que a pesar de sus efectos contralaterales, han aumentado la sobrevivencia de estos pacientes.
Sin embargo, se ha podido observar que el TxO, puede inducir severa perdida de masa ósea, que aumenta el riesgo de fracturas, por múltiples mecanismos, difícilmente recuperable y que debe ser prevenida, tanto con la terapia antiresortiva, como con la utilización de las dosis deletéreas mínimas de la medicación inmunosupresora (1).
En el presente trabajo, vamos a revisar la situación actual de las repercusiones óseas del TxO, con nuestra experiencia, en el Hospital Universitario 12 de Octubre.
DENSIDAD MINERAL ÓSEA (DMO) Y TRASPLANTE
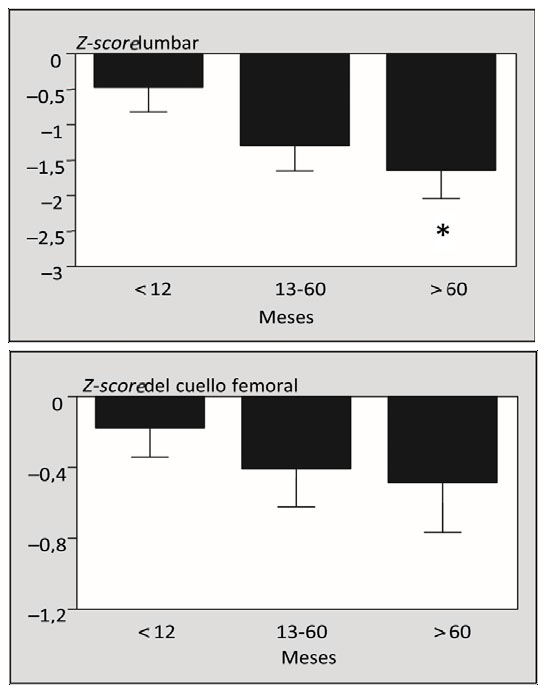
Las alteraciones del metabolismo óseo son muy similares en todos los TxO, independiente del tipo y enfermedad pretrasplante. Después del trasplante se observa una pérdida acelerada de hueso en los primeros 3-6 meses postrasplante. La pérdida de hueso afecta especialmente a la columna y al fémur proximal, encontrando algunos autores una mayor afectación a este último nivel. En pacientes que previamente tenían pérdida ósea, puede entonces haber un mayor aumento del riesgo y en el número de fracturas (2).
A esta inicial pérdida le sigue una fase de recuperación parcial del metabolismo óseo que se inicia a los pocos meses postrasplante (3). Monegal y cols. encontraron recuperación de la DMO a nivel de columna, pero no del fémur proximal, a los 36 meses después del trasplante (4). En el seguimiento a largo plazo de la DMO postrasplante en 360 pacientes con hepatopatías colestásicas, se observó un aumento de la DMO durante los dos primeros años, permaneciendo después la T-score estable durante los 8 años de seguimiento del estudio(5). Sin embargo, Hamburg y cols. encontraron que la recuperación de la DMO era a menudo incompleta hasta 15 años después del trasplante (6).
HISTOMORFOMETRÍA DEL HUESO POSTRASPLANTE
Vedi y cols. mostraron por biopsias obtenidas basalmente y 3 meses postrasplante, aumento del remodelado óseo y aumento del tamaño de las cavidades de resorción (7). Cambios consistentes con la rápida y temprana pérdida ósea que se produce después del trasplante. En cambio, Monegal y cols. refirieron aumento de la formación ósea a los 6 meses del trasplante comparado con los valores basales, con un mayor volumen de osteoide y de su superficie de extensión, pero sin aumento significativo en la superficie de erosión (4).
TRASPLANTE HEPÁTICO (TxH) Y PÉRDIDA ÓSEA
La osteoporosis es una complicación frecuentes de la hepatopatía crónica, siendo su prevalencia elevada entre los pacientes en lista de espera para TxH, especialmente en las colestásicas (8,9,10). Existen múltiples factores de riesgo asociados pretrasplante a esta pérdida de masa ósea (Figura 1).
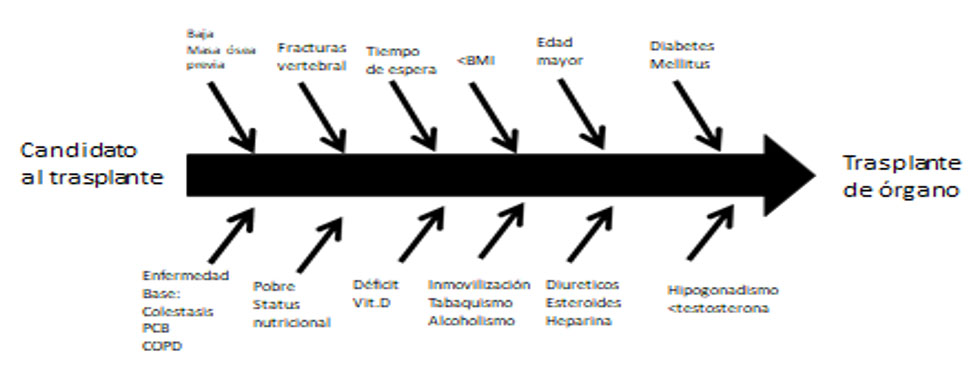
Hemos estudiado la DMO en 51 pacientes candidatos al TxH. encontrando elevada prevalencia de osteoporosis del 27% y de osteopenia del 43% pretrasplante (11). El análisis de la regresión múltiple demostró que el tiempo de espera hasta el TxH, era el factor predictor más importante (Figura 2). Hemos investigado, la impronta de la etiología hepática previa sobre la DMO, comprobando que los pacientes con cirrosis biliar, tenían la menor DMO, en relación a las otras patologías(Tablas 1)(12).

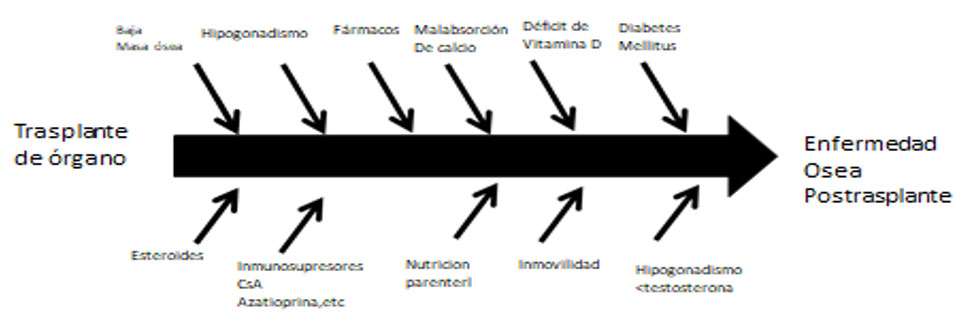
FACTORES POSTRASPLANTES
Los efectos del trasplante y tratamiento inmunosupresor, han sido señalados por varios autores (Figura 3). Nosotros en 71 pacientes que fueron sometidos al TxH , describimos una prevalencia de osteoporosis del 41% que no guardaba asociación con los rechazos ni con las dosis de glucocorticoides, ciclosporina y azatioprina. También encontramos un aumento de la PTH sérica, y de marcadores de remodelado como la osteocalcina y del procolágeno tipo 1, indicando incremento del recambio óseo (13,14). En la actualidad la prevalencia de osteoporosis postrasplante cardiaco referida varía del 11,5-56% en columna lumbar y 15,4-33% en cuello femoral (15,16,17,18,19,20,21).
FRACTURAS Y TxH
Las estimaciones de fractura por fragilidad postrasplante varían ampliamente oscilando entre 25-35%, principalmente en los primeros 6 meses después del trasplante (Tabla 2)(22). En otras publicaciones se ha referido una menor tasa de fracturas (8%) (5). Esto puede deberse a la selección de pacientes, pautas de inmunosupresores, y criterios diagnósticos de fractura vertebral.

En pacientes receptores de TxH, las fracturas más frecuentes son las vertebrales, aunque también se han referido en cadera, pelvis, costillas y muñecas. Las fracturas vertebrales pueden causar dolor y deformidades en la columna, pérdida de altura y una alteración funcional importante. Aunque algunas fracturas vertebrales son asintomáticas, su diagnóstico es importante ya que son predictores independientes de nuevas fracturas.
En la posible disminución de fracturas osteoporóticas postrasplante de las últimas series, influyen varios hechos. En primer lugar, la disminución en las dosis de glucocorticoides (y posiblemente del uso de ciclosporina A, que se ha sustituido por otros fármacos inmunosupresores), y que el trasplante se lleva a cabo en estadios más temprano, lo que disminuye la prevalencia de patología ósea pretrasplante.
FISIOPATOLOGÍA DE LA ENFERMEDAD METABÓLICA ÓSEA
La patogénesis de la enfermedad metabólica ósea es compleja y no bien conocida. Los pacientes pre y postrasplante, están expuestos a diferentes factores que afectan al hueso (23,24,25,26) pero parece que el efecto de la terapia inmunosupresora es fundamental en la inducción de la pérdida ósea postrasplante (Figura 4)(26,27,28).
A) Inmunosupresión
Los inmunosupresores, sirven para evitar el rechazo del órgano del donante por el sistema inmune del receptor. Los glucocorticoides pertenecen al grupo de los inmunosupresores.Otro grupo de inmunosupresores muy utilizados en la actualidad son los agentes de unión a las inmunoglobulinas, que se pueden clasificar como inhibidores de la calcineurina, y los no moduladores de la calcineurina. Entre los primeros se encuentran la CsA y el FK-506. Al segundo grupo pertenecen la rapamicina, el everolimus, micofenolato, metotrexato y la azatioprina.
1. Ciclosporina. La CsA es un undecapéptido aminoacídico cíclico de aproximadamente 1,2 kDa de Pm, extraido del hongo “Tolypocladium inflantum” con mecanismo de acción a través de la interferencia de las señales entre linfocitos T mediadas por interleucinas, que deprime fundamentalmente la inmunidad celular. El FK-506 es una lactona macrólida derivada del hongo “Steptomyces tusukubaensis”, de Pm 803,5 kDa, descubierta en 1984 por Fujisawa Pharmaceutical Co. Ltd. En cambio la rapamicina se une a una imnunofilina intracelular, la FKBP 12 para formar un complejo que se une a la mTor bloqueando la progresión de la fase G1 a fase S del ciclo celular.
En el hueso tienen una acción controvertida. Estudios recientes sugieren que la calcineurina puede regular la diferenciación de osteoblastos y osteoclastos (29,30). En estudios in vitro se ha visto que la CSA inhibe la resorción ósea en osteoclastos aislados e inhibe la formación de osteoclastos en cultivos de medula (31). Sin embargo en estudios en vivo se sugiere que la CsA tiene un efecto adverso independiente en el hueso y en el metabolismo mineral que puede contribuir a la pérdida ósea después del trasplante de órganos. En ratas se produce una rápida perdida de hueso trabecular, afectando también en menor medida al hueso cortical, que puede ser dosis y duración dependiente, produciéndose un incremento marcado tanto de resorción como de formación, incremento de los niveles de osteocalcina y de 1,25(OH)2D (32). La elevación de osteocalcina que acompaña a la administración de ciclosporina, es un indicador de este rápido remodelado, además se considera que este punto discrimina la pérdida ósea producida por GC y la de CsA, ya que los GC son potentes inhibidores de la síntesis de osteocalcina. Parece que esta pérdida es independiente de la función renal, y se asocia a un déficit de testosterona (33).
En trasplante hepático el uso de CsA, no asociado a prednisona, se caracteriza por una significativa menor pérdida de masa ósea, que cuando se utilizan conjuntamente (34). Este mismo hallazgo lo describe Aroldi A y colaboradores en un trabajo en trasplante renal, comparando pacientes en tratamiento con tres regímenes de inmunosupresión, encontrando que los pacientes que reciben CsA, en régimen libre de GC, incrementan la masa ósea a 18 m, disminuyendo en aquellos que mantenían tratamiento con GC (35). En el trasplante cardiaco se ha relacionado el alto remodelado (aumento de osteocalcina e hidroxiprolina en postrasplante tardío, cuando las dosis de prednisona son menores, con un efecto de la CsA (36). El efecto de pérdida ósea observado en cadera postrasplante tardío puede reflejar un aumento de PTH, secundario o de origen desconocido o efecto perjudicial de CsA . Anijar y colaboradores (37) no encuentran relación entre la DMO postrasplante (25.4±21.1meses) y la dosis acumulada de CsA, y si encuentran relación con la dosis acumulada de GC.
2.Azatioprina es un antimetabolito con actividad antiproliferativa a través de la interferencia con la síntesis del ácido desoxirribonucleico. Afecta de forma predominante la inmunidad celular y en menor grado la inmunidad humoral.
3.Tacrolimus (FK 506).Inhibidor calcineiurínico que frena la expresión del gen de citoquinas la activación de las células T y su proliferación, causando también perdida de hueso trabecular en las ratas (31). Difiere de la CsA en que no produce una elevación de los niveles de osteocalcina y de 1,25(OH)2D . En trasplante cardiaco se ha comunicado rápida pérdida ósea con este fármaco, aunque el régimen de inmunosupresión incluía esteroides (38), y parece que causa menor pérdida ósea en humanos que la CsA(39).
Hay información limitada sobre el efecto de otras drogas inmunosupresoras en la DMO y el metabolismo óseo (Tabla 3). La asociación de Azatioprina y CsA no aumenta la osteopenia producida por la CsA (40). El tacrolimus (FK506) es un inhibidor de la calcineurina que suprime la activación de la célula T así como la producción y liberación de IL-2 y otras citocinas. A nivel óseo induce una severa pérdida de hueso trabecular en ratas, aunque parece ser menos severa en humanos. El mofetil micofenolato, no ha mostrado efectos a nivel óseo en modelos murinos.

B) Glucocorticoides
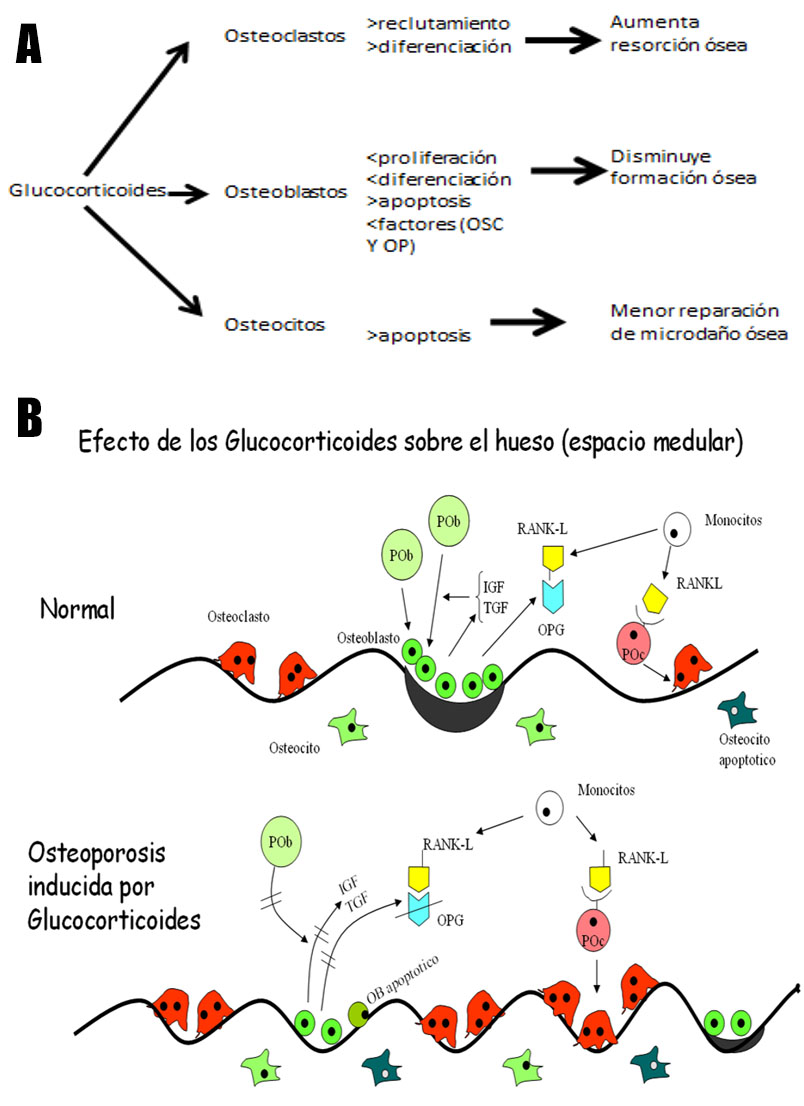
La osteoporosis inducida por glucocorticoides es multifactorial. La administración prolongada de esteroides induce pérdida ósea en dos fases: una temprana con rápida disminución de la DMO, y una mas tardía, caracterizada por una perdida menor y disminución de la capacidad d recuperación Tienen un efecto indirecto sobre el hueso inhibiendo la absorción de calcio gastrointestinal, y la reabsorción renal de calcio y disminuyendo la síntesis de vitamina D en el riñón. A nivel gonadal, disminuyen la producción de estrógenos y andrógenos, favoreciendo la resorción ósea. Los efectos directos se realizan sobre los osteoblastos, osteoclastos y osteocitos. Sobre los osteoblastos, inhiben su función y su número, incrementando su apoptosis. La disminución de su función, se acompaña de una menor síntesis de colágeno. Sobre los osteoclastos, estimulan su diferenciación, aumentando factores pre-osteoclastogenesis, (factor estimulante de colonia de macrófago, y del receptor RANK-L), y disminuyendo la osteoprotegerina (factor inhibidor de la osteoclastogénesis). También disminuye la apoptosis de los osteoclastos, llevando efectos a un reforzamiento de la resorción ósea. Finalmente sobre los osteocitos, se estimula su apoptosis y se inhibe su función normal, disminuyendo la fuerza ósea (41,42).
El impacto potencial de la dosis de glucocorticoides como determinante de la pérdida de hueso se apoya por la ausencia de pérdida de hueso a nivel lumbar y de fémur proximal encontrada en pacientes con trasplante renal tratados con bajas dosis de esteroides y tacrolimus (43). Nosotros hemos confirmado que la disminución y retirada de GC después del trasplante aceleró la recuperación de la DMO lumbar (Z-score -0,44 en el grupo con retirada precoz de prednisona vs. Z-score -0,99 en los pacientes en los que se mantenía prednisona; p<0,05), sin efectos adversos en la tolerancia del injerto (34) ).
TRATAMIENTO DE LA OSTEOPOROSIS POSTRANSPLANTE
La aproximación terapéutica a la pérdida ósea de los TxO no está consensuada. El escaso número de estudios aleatorizados y el pequeño tamaño de las series de pacientes han limitado la posibilidad de extraer conclusiones. El tratamiento general implica seguir las medidas para la prevención de la osteoporosis: suprimir tabaco y alcohol; administrar adecuadamente suplementos de calcio y vitamina D, en dosis similares a la recomendadas para la osteoporosis posmenopaúsica.
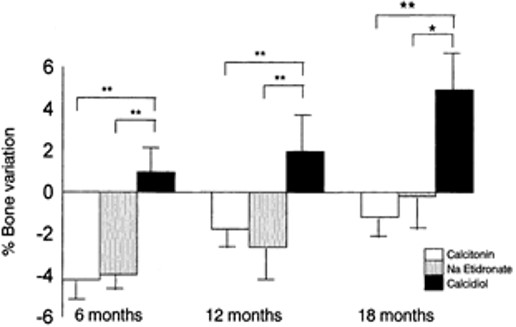
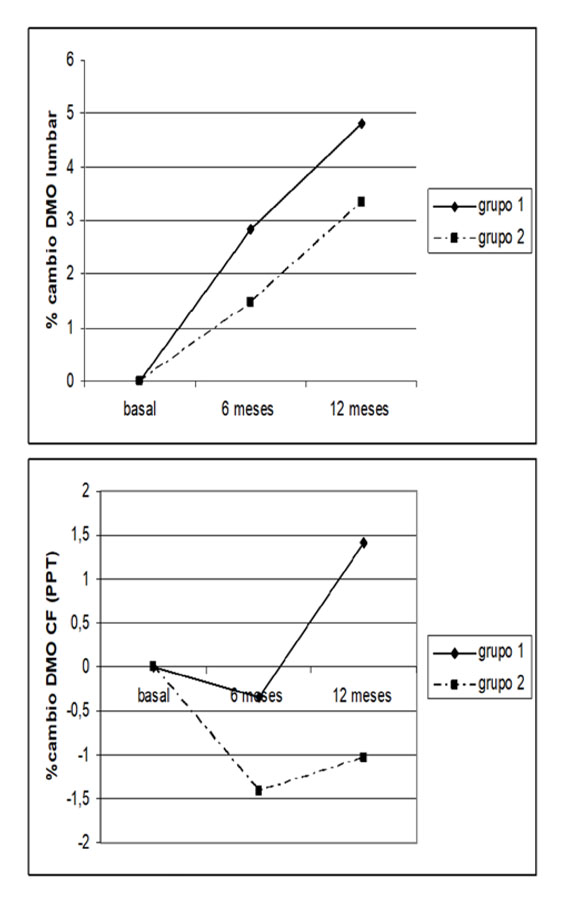
Los bisfosfonatos son en la actualidad el fármaco más efectivo y utilizado en el tratamiento de la enfermedad ósea postrasplante. Nosotros hemos descritos los efectos de la Calcitonina vs. Etidronato cíclico en la DMO lumbar de 120 pacientes con trasplante hepático (12), tratados durante 18 meses. El Etidronato produjo un incremento del 8.2%, frente a la calcitonina de 6.4% de la DMO. En otros 40 pacientes con trasplante cardiaco, evaluamos el tratamiento con calcidiol, que demostró superioridad frente al etidronato y la calcitonina (Figura 5) (11).En un trabajo de Guichelaar y cols. (44) en trasplantados hepáticos, el análisis histomorfométrico mostró que la calcitonina (n=14 calcitonina, n= 19 control) no tuvo efecto ni directo (número de osteoclastos, superficie de erosión) ni indirecto (grosor, número y separación trabecular) sobre los parámetros de resorción ósea. Hemos realizado una comparación de la administración de alendronato, etidronato, calcitonina y vitamina D3, en pacientes con TxH. El alendronato, se confirmó como el más potente antirresortivo y frenador de la pérdida ósea frente a los otros (45). Otros estudios con ibandronato, ácido zolendrónico y pamidronato,en diferentes TxO han demostrado también eficacia en la prevención de la pérdida ósea (46). Recientemente, describimos que 45 pacientes con TxH y tratados con Risedronato (RSN) presentaron aumento significativo de la masa ósea lumbar a los 6 y 12 meses comparados con los tratados con calcio y vitamina D (Figura 6) (47).La utilización del índice trabecular TBS, no demostró mejoría en la microestructura trabecular en el año transcurrido de terapia con risedronato, sugiriendo la necesidad de terapia más prolongada (48).
CONCLUSIONES
La Enfermedad Ósea Postrasplante con/sin aumento de fracturas puede contribuir a una mayor morbilidad y mortalidad y pérdida de calidad de vida. Los mecanismos de la pérdida ósea son multifactoriales, e incluyen factores pretrasplante y postrasplante (glucocorticoides y otras medicaciones inmunosupresora). La monitorización de la masa ósea es necesaria para tomar la decisión de tratamiento. Los bisfosfonatos combinados con calcio y vitamina D, son las opciones terapéuticas recomendadas.
AGRADECIMIENTOS
A la Fundación para la Investigación en Osteoporosis y Enfermedades Endocrinas por su apoyo en la realización de estas investigaciones.
BIBLIOGRAFÍA
- Lofdahl E, Radegran G. Osteoporosisfollowing heart transplantation and immunosuppressive therapy. Transplant Rev 107; 201: 232-239.
- Stein E, Ebeling P, Shane E. Post-transplantation osteoporosis. Endocrinol Metab Clin North Am 2007; 36(4): 937-963.
- Kulak CA, Borba VZ, Kulak Júnior J, Campos DJ, Shane E. Posttransplantation osteoporosis. Arq Bras Endocrinol Metabol 2010; 54(2): 143-149.
- Monegal A, Navasa M, Guanabens N, et al. Bone disease after liver transplantation: a long-term prospective study of bone mass changes, hormonal status and histomorphometric characteristics. Osteoporos Int 2001; 12(6): 484-492.
- Guichelaar MM, Kendall R, Malinchoc M, Hay JE. Bone mineral density before and after OLT: long-term follow-up and predictive factors. Liver Transpl 2006; 12(9): 1390-1402.
- Hamburg SM, Piers DA, van den Berg AP, Slooff MJ, Haagsma EB. Bone mineral density in the long term after liver transplantation. Osteoporos Int 2000; 11(7): 600-606.
- Vedi S, Greer S, Skingle SJ, et al. Mechanism of bone loss after liver transplantation: a histomorphometric analysis. J Bone Miner Res 1999; 14(2):281-287.
- Ninkovic M, Love SA, Tom B, Alexander GJ, Compston JE. High prevalence of osteoporosis in patients with chronic liver disease prior to liver transplantation. Calcif Tissue Int 2001; 69(6): 321-326.
- Guichelaar MM, Kendall R, Malinchoc M, Hay JE. Bone mineral density before and after OLT: long-term follow-up and predictive factors. Liver Transpl 2006; 12(9):1390-1402.
- Floreani A, Mega A, Tizian L et al. Bone metabolism and gonad function in male patients undergoing liver transplantation: a two-year longitudinal study. Osteoporos Int 2001; 12(9): 749-754.
- García-Delgado I, Prieto S, Gil-Fraquas L, Robles E, Rufilanchas JJ, Hawkins F. Calcitonin, etidronate, and calcidiol treatment in bone loss after cardiac transplantation. Calcif Tissue Int 1997; 60(2): 155-159.
- Valero MA, Loinaz C, Larrodera L, León M, Moreno E, Hawkins F. Calcitonin and bisphosphonates treatment in bone loss after liver transplantation. Calcif Tissue Int 1995; 57(1): 15-19.
- Hawkins FG, León M, López MB, et al. Bone loss and turnover in patients with liver transplantation. Hepatogastroenterology 1994; 41(2): 158-161.
- López MB, González Pinto I, Hawkins F, et al. Effect of liver transplantation and immunosuppressive treatment on bone mineral density. Transplant Proc 1992; 24(6): 3044-3046.
- Rodino MA, Shane E. Osteoporosis after organ transplantation. Am J Med 1998; 104(5): 459-469.
- Wang H, Jiang W, Zhou Z, et al. Liver transplantation in mainland China: the overview of CLTR 2011 annual scientific report. Hepatobiliary Surg Nutr 2013; 2(4):188-197.
- Dolgos S, Hartmann A, Isaksen GA, et al. Osteoporosis is a prevalent finding in patients with solid organ failure awaiting transplantation – a population based study. Clin Transplant 2010; 24(5): E145-152.
- Danovitch GM, Cohen DJ, Weir MR, et al. Current status of kidney and pancreas transplantation in the United States, 1994-2003. Am J Transplant 2005; 5(4 Pt 2): 904-915.
- Bianda T, Linka A, Junga G, et al. Prevention of osteoporosis in heart transplant recipients: a comparison of calcitriol with calcitonin and pamidronate. Calcif Tissue Int 2000; 67(2): 116-121.
- Negri AL, Perrone S, Gallo R, Bogado CE, Zanchetta JR. Osteoporosis following heart transplantation. Transplant Proc 1996; 28(6): 3321-3324.
- Thiébaud D, Krieg MA, Gillard-Berguer D, Jacquet AF, Goy JJ, Burckhardt P. Cyclosporine induces high bone turnover and may contribute to bone loss after heart transplantation. Eur J Clin Invest 1996; 26(7): 549-555.
- Eshane E, Epstein S. Transplantation osteoporosis. Transplant Rev 2001: 15: 11-13.
- Shane E, Rivas M, McMahon DJ, Staron RB, Silverberg SJ, Seibel MJ. Bone loss and turnover after cardiac transplantation. J Clin Endocrinol Metab 1997; 82(5): 1497-1506.
- Pisani B, Mullen GM. Prevention of osteoporosis in cardiac transplant recipients. Curr Opin Cardiol 2002; 17(2): 160-164.
- Maalouf NM, Shane E. Osteoporosis after solid organ transplantation. J Clin Endocrinol Metab 2005; 90(4): 2456-2465.
- Chauhan V, Ranganna KM, Chauhan N, Vaid M, Kelepouris E. Bone disease in organ transplant patients: pathogenesis and management. Postgrad Med 2012; 124(3): 80-90.
- Kulak CA, Borba VZ, Kulak Júnior J, Shane E. Transplantation osteoporosis. Arq Bras Endocrinol Metabol 2006; 50(4): 783-792.
- Stein E, Ebeling P, Shane E. Post-transplantation osteoporosis. Endocrinol Metab Clin North Am 2007; 36(4): 937-963.
- Sun L, Blair HC, Peng Y, et al. Calcineurin regulates bone formation by the osteoblast Proc Natl Acad Sci U S A 2005; 102(47): 17130-17135.
- Sun L, Peng Y, Zaidi N, et al. Evidence that calcineurin is required for the genesis of bone-resorbing osteoclasts.Am J Physiol Renal Physiol 2007; 292(1): F285-291.
- Cvetkovic M, Mann GN, Romero DF, et al. The deleterious effects of long-term cyclosporine A, cyclosporine G, and FK506 on bone mineral metabolism in vivo. Transplantation 1994 27; 57(8): 1231-1237.
- Epstein S. Post-transplantation bone disease: the role of immunosuppressive agents and the skeleton. J Bone Miner Res 1996; 11(1): 1-7.
- Bowman AR, Sass DA, et al. The role of testosterone in cyclosporine-induced osteopenia. J Bone Miner Res 1997; 12(4): 607-615.
- Martínez Díaz-Guerra G, Gómez R, Jódar E, Loinaz C, Moreno E, Hawkins F. Long-term follow-up of bone mass after orthotopic liver transplantation: Effect of steroid withdrawal from the immunosuppressive regimen. Osteoporos Int 2002; 13(2): 147-150.
- Aroldi A, Tarantino A, Montagnino G, Cesana B, Cocucci C, Ponticelli C. Effects of three immunosuppressive regimens on vertebral bone density in renal transplant recipients: a prospective study. Transplantation 1997 15; 63(3): 380-386.
- Shane E, Rivas MC, Silverberg SJ, Kim TS, Staron RB, Bilezikian JP. Osteoporosis after cardiac transplantation. Am J Med 1993; 94(3): 257-264.
- Anijar JR, Szejnfeld VL, Almeida DR, Fernandes AR, Ferraz MB. Reduced bone mineral density in men after heart transplantation. Braz J Med Biol Res 1999; 32(4): 413-420.
- Stempfle HU, Werner C, Siebert U, et al. The role of tacrolimus (FK506)-based immunosuppression on bone mineral density and bone turnover after cardiac transplantation: a prospective, longitudinal, randomized, double-blind trial with calcitriol. Transplantation 2002 27; 73(4): 547-552.
- Goffin E, Devogelaer JP, Lalaoui A, et al. Tacrolimus and low-dose steroid immunosuppression preserves bone mass after renal transplantation. Transpl Int 2002; 15(2-3): 73-80.
- Bryer HP, Isserow JA, Armstrong EC, et al. Azathioprine alone is bone sparing and does not alter cyclosporin A-induced osteopenia in the rat. J Bone Miner Res 1995; 10(1): 132-138.
- Hayashi K, Yamaguchi T, Yano S, et al. BMP/Wnt antagonists are upregulated by dexamethasone in osteoblasts and reversed by alendronate and PTH: potential therapeutic targets for glucocorticoid-induced osteoporosis. Biochem Biophys Res Commun 2009 6; 379(2): 261-266.
- Giannini S, Nobile M, Ciuffreda M, et al. Long-term persistence of low bone density in orthotopic liver transplantation. Osteoporos Int 2000; 11(5): 417-424.
- Goffin E, Devogelaer JP, Depresseux G, Squifflet JP, Pirson Y. Osteoporosis after organ transplantation. Lancet 2001 19; 357(9268): 1623.
- Guichelaar MM, Malinchoc M, Sibonga J, Clarke BL, Hay JE. Immunosuppressive and postoperative effects of orthotopic liver transplantation on bone metabolism. Liver Transpl 2004; 10(5): 638-647.
- Gilfraguas L, Guadalix S, Martínez G, et al. Bone loss after heart transplant: effect of alendronate, etidronate, calcitonin and calcium plusvitamin D3. Prog Transplant 2012; 22(3): 237-243.
- Nel JD, Epstein S. Metabolica bone disease in the post-transplant population. Med Clin Nam 2016; 100: 569-586.
- Guadalix S, Martínez-Díaz Guerra G, Lora D, et al. Effect of early risedronate treatment onbone mineral density and bone turnover markers after liver transplantation: a prospective single-center study. Transplant Int 2011; 24 (7): 657-665.
- Librizzi MS, Guadalix S, Martínez-Díaz Guerra G, et al. Trabecular bone score in patients with liver transplants after1 year of risedronate treatment. Transpl Int 2016; 29(3): 331-337.
DECLARACIÓN DE TRANSPARENCIA
El autor/a de este artículo declara no tener ningún tipo de conflicto de intereses respecto a lo expuesto en la presente revisión.
ranm tv
Federico Hawkins Carranza
Real Academia Nacional de Medicina de España
C/ Arrieta, 12 · 28013 Madrid
Tlf.: +34 91 159 47 34 | Federico.hawkins@salud.madrid.org
Año 2019 · número 136 (03) · páginas 249 a 255
Enviado*: 22.01.19
Revisado: 29.01.19
Aceptado: 22.02.19
* Fecha de lectura en la RANM


