Resumen
Las técnicas de reanimación cardiopulmonar constituyen una combinación de maniobras utilizadas en aquellas situaciones que cursan con la brusca interrupción de la respiración y de la circulación espontánea, siempre que se produzca de manera inesperada y sea potencialmente reversible.
La asistencia mecánica circulatoria ya ha sido expuesta anteriormente (1,2), por lo que nos centraremos en la asistencia mecánica respiratoria en esta publicación.
Abstract
The techniques of cardipulmonary recovery constitue a combination of manouvers used in those ocassions that occur with the sudden interruption of breathing and spontaneous circulation, only if it occurs in an unexpected way and is potentially reversible.
Mechanical circulatory support has been previously exposed (1,2), thus we will focus on mechanical respiratory support in this publication.
Palabras clave: Insuficiencia respiratoria abrupta; Respiradores; Pulmón de acero; Neumotórax; Ahogamiento; Atraganta miento; Cámara de hipopresión; Oxigenación de membrana extracorpórea; ECMO; Ventilación líquida; Perfluorocarbonados.
Keywords: Sudden respiratory insufficiency; Respirators; Still lung; Pneumothorax; Drowning; Choking; Low-pressure chamber; Extracorporeal membrane oxygenation; ECMO; Liquid ventilation; Perfluorocarbons.
ANTECEDENTES HISTÓRICOS
Los procedimientos de asistencia mecánica respiratoria se remontan mayoritariamente a los años 50 del siglo pasado, y se inician con la descripción de las maniobras para mantener la apertura de la vía aérea, ventilación boca a boca, masaje cardíaco externo y posibilidad de desfibrilación eléctrica. Las causas de la parada cardiorrespiratoria son múltiples y variadas. Entre las de etiología respiratoria encontramos ahogamientos, atragantamientos, traumatismos, inhalación de humos, electrocución, etc.
Actualmente está establecido (3) un protocolo de actuación sistematizado que incluye dos fases: Fase 1, soporte vital básico (SVB) y Fase 2, soporte vital avanzado (SVA).
Fase I: soporte vital básico (SVB).
El SVB debe iniciarse de manera rápida y reglada, siguiendo las siguientes pautas:
A. Vía aérea
Al sufrir una parada cardiorrespiratoria, el cese del flujo sanguíneo al cerebro provoca en pocos segundos pérdida de la conciencia. En ausencia de conciencia y de tono muscular la lengua y la epiglotis obstruyen la faringe y laringe, haciéndose prioritario mantener permeable la vía aérea. Puede conseguirse mediante la extensión del cuello asociado a un desplazamiento anterior de la barbilla (Fig. 1).

Si con la vía aérea permeable el paciente no respira, la administración boca a boca del aire espirado es el método más rápido para suministrar oxígeno suficiente a los tejidos, en espera de establecer lo antes posible otras técnicas de oxigenación y ventilación más complejas y eficaces.
Complementariamente deberá hacerse masaje cardíaco externo, ya comentado en una presentación previa(1) de asistencia mecánica circulatoria.
Fase II: soporte vital avanzado (SVA).
Esta fase tiene como objetivo optimizar el transporte de oxígeno tisular , además de establecer el diagnóstico y tratamiento específico de la causa etiológica y de los mecanismos de la parada cardiorrespiratoria. Se completa el ARC básico (vía aérea, respiración y circulación) de la fase anterior con la ayuda de equipos auxiliares, continuando posteriormente con nuevos pasos sucesivos:
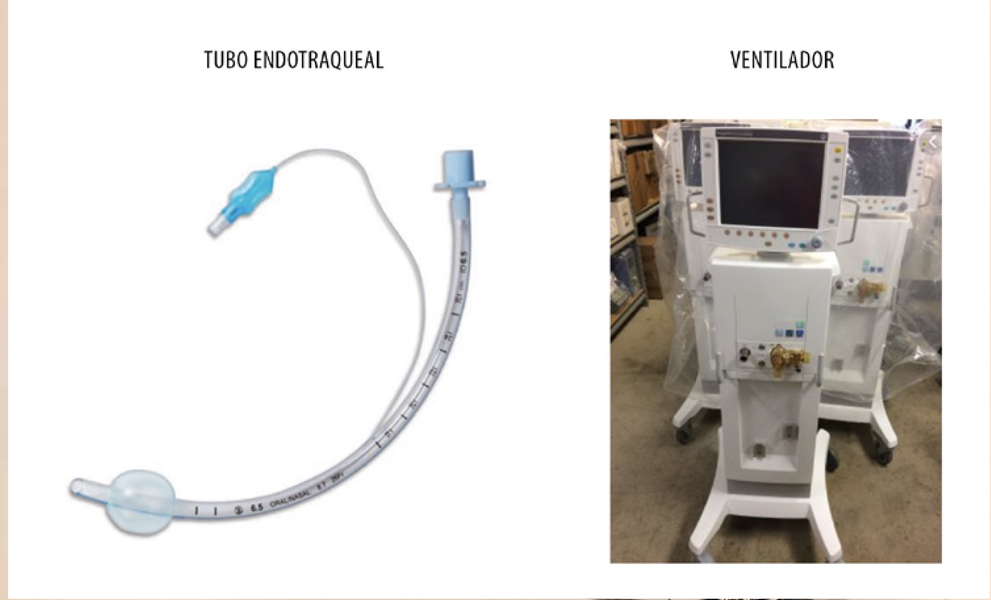
- Dispositivos útiles para mantener permeable la vía aérea, como el tubo de Guedel (Fig. 2) orofaríngeo. Pero es la intubación endotraqueal el método definitivo para asegurar la vía aérea y mantener la independiente del tubo digestivo. Debe practicarse lo antes posible.

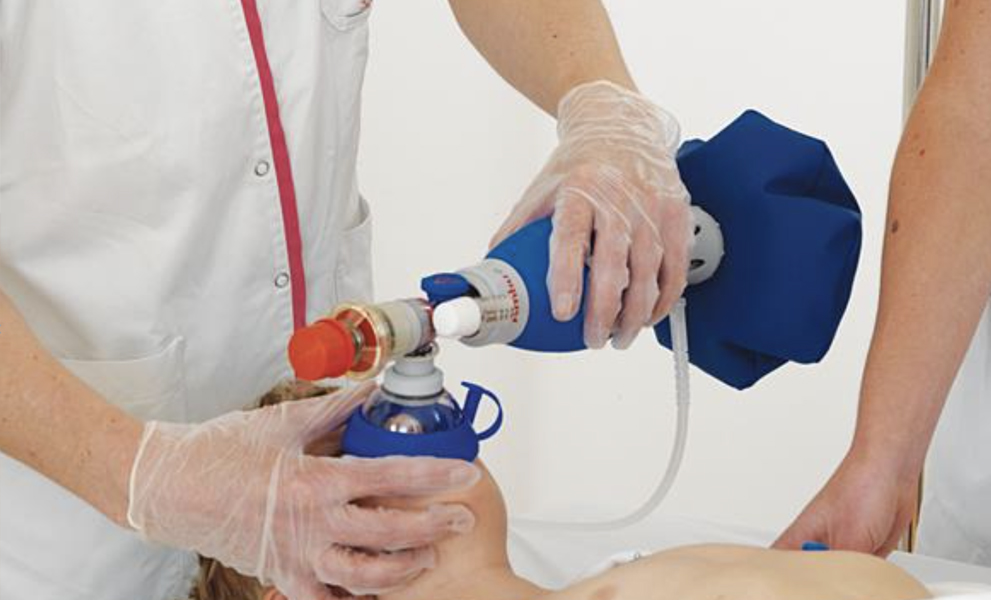
- Ventilación manual, mediante un sistema de bolsa autohinchable con válvula unidireccional y mascarilla, denominado Ambú (Fig. 3). Es más eficaz que el boca a boca, y alcanza su máxima eficacia ajustado a un tubo endotraqueal.
- Aparatos mecánicos (carro de parada cardiaca), utilizados para realizar una compresión torácica. Emplean un pistón montado sobre una tabla rígida, que está impulsado por aire comprimido. Se intenta así mejorar la compresión externa, ajustando su intensidad y frecuencia, además de disminuir la fatiga del personal reanimador.
- Respiradores. Son máquinas utilizadas en anestesia y en las Unidades de Cuidados Intensivos, para instaurar y mantener una ventilación artificial en el paciente. Fundamentalmente se componen de una fuente de gas presurizada, un generador que insufla el gas a favor de un gradiente de presión y de un circuito que llega hasta la vía aérea del paciente. A través de un vaporizador se pueden administrar diferentes concentraciones de gases anestésicos. La ventilación pulmonar a través del respirador puede ser controlada total o parcialmente por la máquina o por una ventilación asistida (Fig. 4).

Los ventiladores se clasifican como volumétricos o manométricos según que la ventilación pulmonar sea controlada por el volumen o por la presión del gas administrado respectivamente.
Pulmón de acero
Es una gran máquina que permite respirar a una persona cuando ha perdido el control de sus músculos, o porque el trabajo de respiración excede o sobrepasa la capacidad de esa persona.
Fue inventado por Drinker y Agassiz Shaw, originalmente para el tratamiento del envenenamiento por monóxido de carbono. Pero su mayor utilización se produjo a mediados del siglo XX, en víctimas aquejadas de poliomielitis, que por el deterioro de las neuronas motoras bulbares presentaban una atrofia muscular progresiva, que condicionaba una parálisis diafragmática y secundariamente una incapacidad respiratoria.
El pulmón de acero fue utilizado por primera vez en octubre de 1928 en el Children’s Hospital de Boston, Massachusetts, en una niña inconsciente con problemas respiratorios. Su gran recuperación, a los pocos segundos de ser introducida en la cámara, popularizó inmediatamente el “Drinker respirator”.
El paciente se introduce en una cámara cilíndrica central (Fig. 5) de acero, por una apertura que posteriormente se cierra herméticamente, pero que permite que tanto la cabeza como el cuello estén libres, mientras que permanece absolutamente sellado el resto del cuerpo de la persona (Fig. 6).


El dispositivo bombea un flujo de aire que sucesivamente reduce e incrementa la presión del aire dentro de la cámara y, por consiguiente, en el tórax. Cuando la presión disminuye en el pulmón de acero, los pulmones del paciente se expanden, ingresando el aire exterior a través de la nariz de la persona, lo que permite mantener sus pulmones llenos de aire atmosférico. Cuando la presión del pulmón de acero aumenta, ocurre lo contrario y se expulsa el aire del paciente porque se comprime su tórax. De esta manera, el pulmón de acero imita la acción fisiológica de la respiración. Mediante un cambio periódico de la presión intratorácica, posibilita que el aire fluya dentro y fuera de los pulmones. A pesar de su aparatosidad, el pulmón de acero es una forma de terapia no invasiva.
En 1931, el mecánico John Haven Emerson mejoró el pulmón de acero de Drinker y Shaw, reduciendo su tamaño, haciéndolo más barato, ligero, silencioso y fiable.
Las salas de los hospitales se llenaron de pulmones de acero de Emerson durante el brote de poliomielitis de los años 1940 y 1950 (Fig. 7). Posteriormente, con el éxito mundial de los programas de vacunación contra la poliomielitis, se erradicó prácticamente la enfermedad. Aquí un merecido homenaje al Dr. Salk (1914-1995), el inmunólogo norteamericano que desarrolló la primera vacuna antipoliomielítica eficaz, y que asociado con la llegada de respiradores más modernos que controlan la respiración a través de la intubación de la vía respiratoria, el uso del pulmón de acero declinó bruscamente.

El ventilador de presión positiva, que permite el ingreso del aire en los pulmones del paciente mediante la intubación de la vía respiratoria, se utilizaría por primera vez en Dinamarca, en el Hospital Blegdams, Copenhague, durante un brote de poliomielitis el año 1952. Fue tal su éxito, que rápidamente reemplazó el pulmón de acero en toda Europa. Pero el uso clínico del pulmón de acero, tuvo también una importancia adicional: la necesidad de tratar en los hospitales a muchos pacientes con procesos patológicos graves, aumentando la eficacia y disminuyendo los costes, hizo que surgieran las Unidades de Cuidados Intensivos (Fig.8).

Neumotórax
Consiste en la presencia de aire en el espacio pleural. Puede aparecer de manera espontánea, sin antecedentes de traumatismo y otras veces es consecuencia de un accidente traumático o bien iatrogénico, secundario a maniobras diagnósticas o terapéuticas.
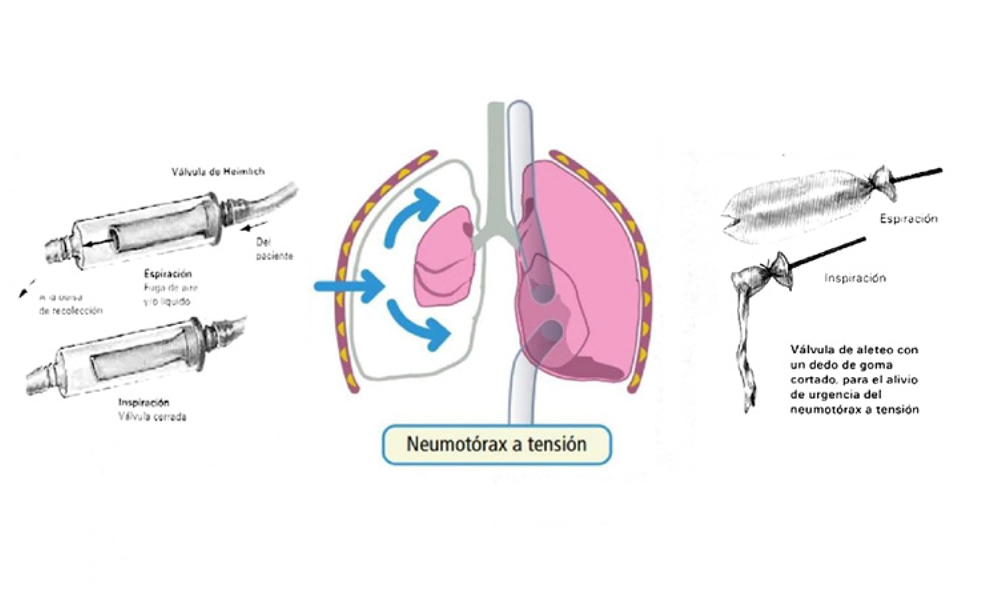
La cantidad de aire puede variar desde unos pocos centímetros cúbicos hasta producir el colapso completo del pulmón, incluso con desplazamiento mediastínico contralateral (neumotórax a tensión). Esta circunstancia se produce cuando la presión intrapleural excede a la presión atmosférica, durante todo el ciclo respiratorio, porque se establece un mecanismo valvular que permite pasar el aire a la pleura, pero que le impide salir de nuevo a la atmósfera, al exterior, produciendo un rápido deterioro de la función cardiopulmonar, con disminución del gasto cardíaco secundario a una disminución del retorno venoso. Como consecuencia, se produce hipoxemia severa y acidosis respiratoria, lo que compromete la vida del paciente en un corto plazo de tiempo.
El neumotórax a tensión es una emergencia y, en ocasiones, no se puede esperar a disponer de una radiografía de tórax para corroborar el diagnóstico clínico. El tratamiento rápido consistirá en colocar un tubo de tórax conectado a un frasco con aspiración, sellado con una cámara de agua tipo Bilau. Cuando no se disponga de estos medios, será preciso comunicar urgentemente el espacio pleural con la atmósfera mediante una punción con el primer procedimiento que se tenga a mano. Resulta muy útil y eficaz colocar una válvula de Heimlich (Fig. 9), que puede fabricarse e improvisarse con un dedo de guante cortado (válvula de aleteo) que se colapsa durante la inspiración y que permite la salida de aire durante la espiración, consiguiéndose el alivio urgente del neumotórax a tensión.
Ahogamiento
Es un proceso en el que se experimenta un impedimento respiratorio por la sumersión o inmersión en un medio líquido. Aunque parece términos sinónimos, el ahogamiento posee estos dos mecanismos de acción:
Inmersión, cuando solo el rostro de una persona está dentro del medio líquido, especialmente la boca o la nariz, o ambas.
Sumersión, cuando es el cuerpo en su totalidad el que está dentro del medio líquido.
El ahogamiento es un tipo de asfixia provocada por la inundación de las vías respiratorias. La posición lateral de seguridad (Fig. 10) es una postura de recuperación o de primeros auxilios en la que debe colocarse a un paciente inconsciente, pero que aún conserva o mantiene la respiración, para prevenir que sufra posteriores daños debidos al ahogamiento.

Atragantamiento
Se produce cuando durante la deglución, una porción de comida o por deglución accidental de un cuerpo extraño, lo ingerido queda detenido en la garganta, produciéndose inmediatamente una repentina sensación de ahogo, que puede conducir a una muerte inminente, a menos que se pueda conseguir expulsar el cuerpo extraño o el alimento obstructivo de la vía aérea.
En esta dramática situación es muy útil realizar la maniobra de Heimlich (Fig. 11), colocándose una persona detrás del paciente, rodeando el reborde inferior del tórax con ambas brazos y ejerciendo con los puños varios movimientos violentos de presión sobre la base del tórax, hasta conseguir la expulsión del alimento o cuerpo extraño atascado en la garganta.

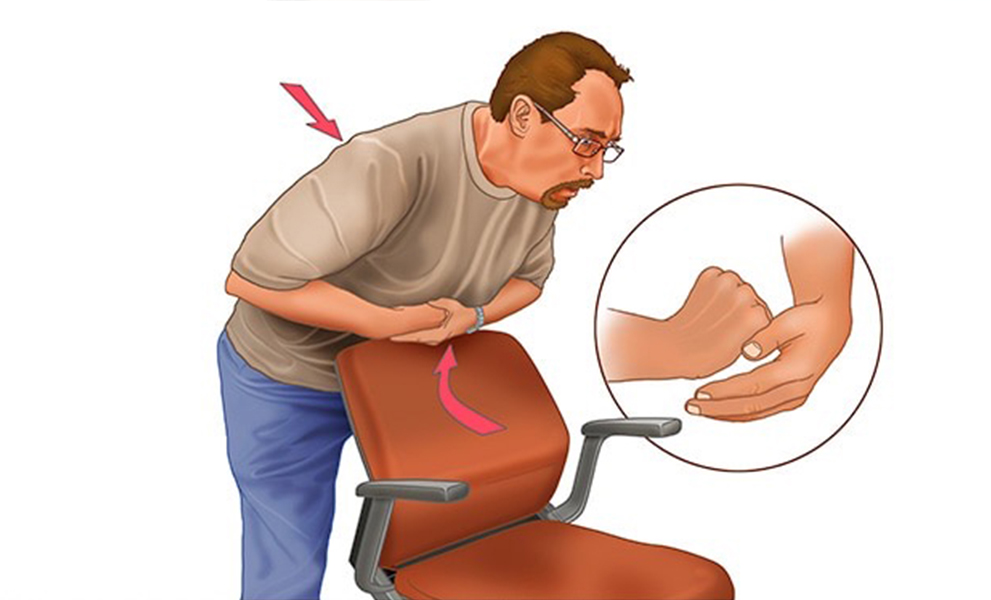
Si no fuera posible la ayuda de alguna persona que sepa ejecutar la maniobra, es posible que lo intente el propio atragantado apoyando fuertemente la base de su tórax en el respaldo de un asiento y ejerciendo una presión hacia adelante con ambas manos comprimir violentamente sobre el respaldo hasta conseguir la expulsión del motivo del atragantamiento (Fig. 12).
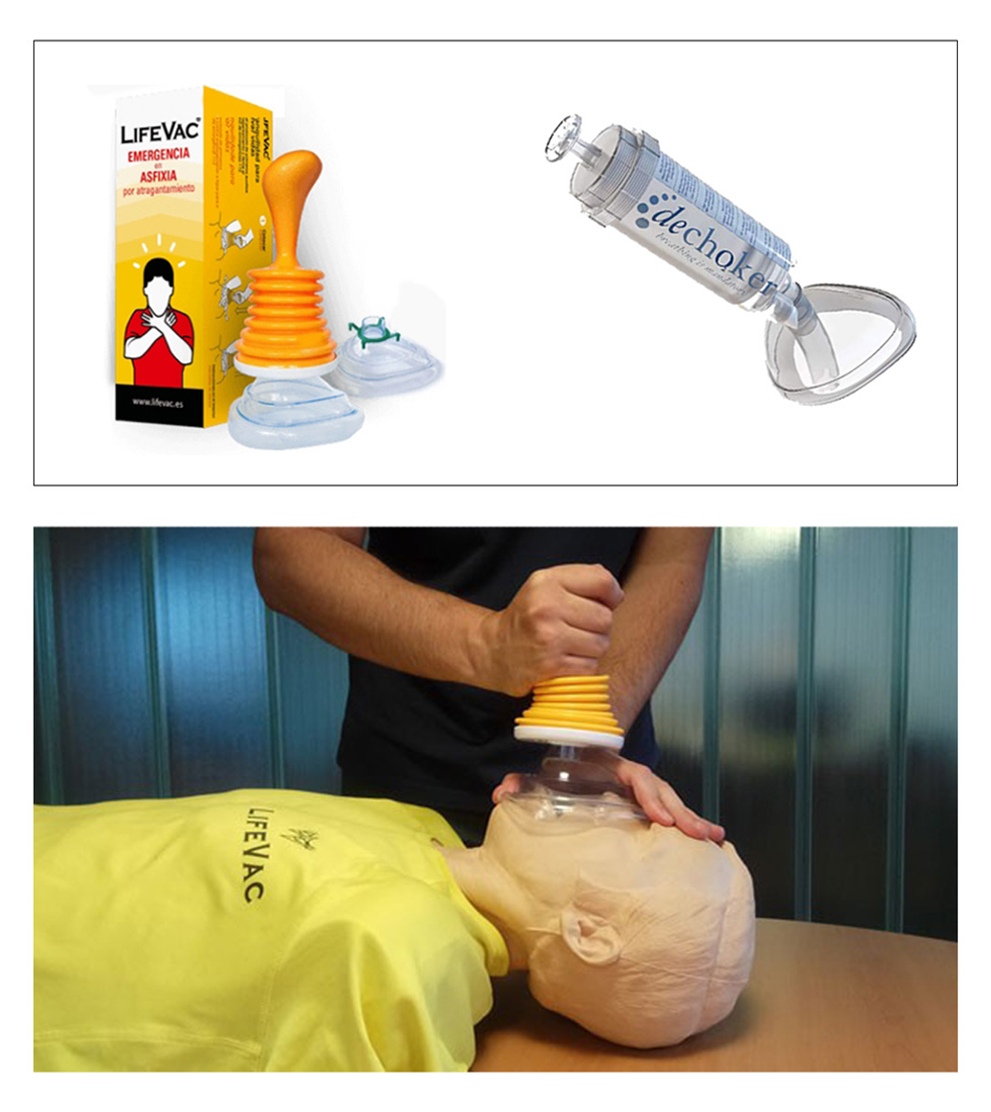
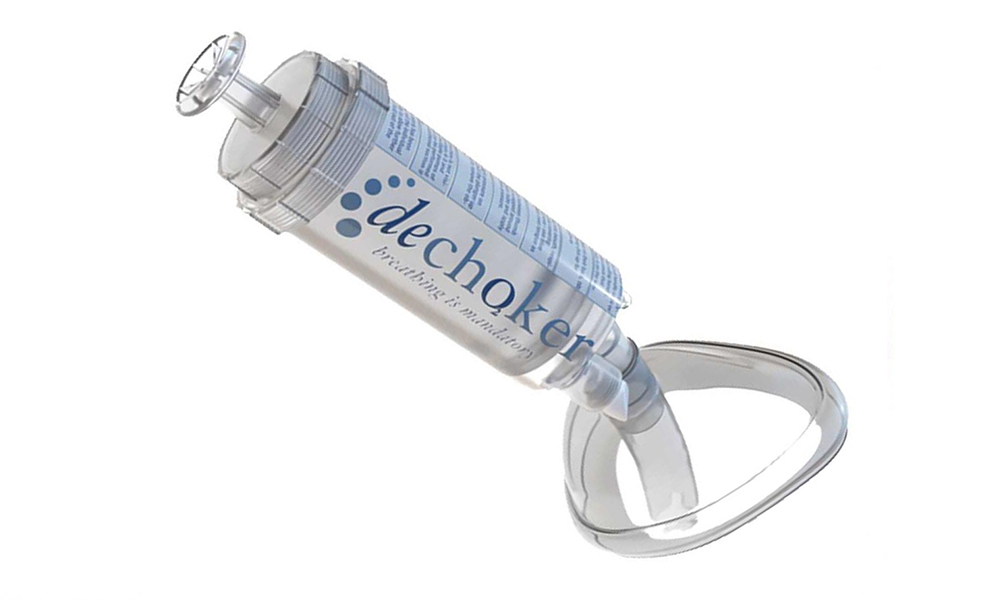
Actualmente, existen también en el mercado unos desatascadores de fuelle, Lifevac (Fig. 13) y el modelo Dechoker (Fig. 14), que fundamentalmente consiste en una jeringa gigante para ejercer una aspiración violenta e intensa. Estos últimos dispositivos no tienen aún el respaldo de la comunidad científica ni de las autoridades sanitarias.
Fisioterapia respiratoria
Pretende la prevención, tratamiento y estabilización de las disfunciones o alteraciones respiratorias para mejorar la ventilación pulmonar, el intercambio de gases, la función de los músculos respiratorios, la disnea, la tolerancia al ejercicio y calidad de vida. Son técnicas de intervención terapéutica destinadas a la desobstrucción de las vías aéreas, la reeducación respiratoria y la readaptación al esfuerzo. Es un método terapéutico de reducido costo y demostrada eficacia en afectaciones crónicas del sistema respiratorio o en intervenciones quirúrgicas de gran complejidad, como trasplantes pulmonares cardíacos o hepáticos, además de otro tipo de intervenciones cardiotorácicas. En la figura (Fig. 15) se muestra unos de estos dispositivos de uso habitual en todos los centros hospitalarios.

Condicionantes para el inicio de la cirugía torácica
La principal función del pulmón es realizar el intercambio gaseoso, captando oxígeno (O2) del aire ambiental y eliminando el dióxido de carbono (CO2) al exterior del tórax, según las necesidades metabólicas del momento. Para cumplir este objetivo es preciso conducir el aire desde el exterior hasta la zona de intercambio de gases (los sacos alveolares) y eliminarlo una vez extraído el O2 de él y se ha aportado el CO2.
Se conoce como ventilación, en fisiología respiratoria, a la movilización del aire que se genera durante el acto respiratorio. Para que ocurra este movimiento, ha de generarse en la inspiración una presión intratorácica inferior a la atmosférica. Se consigue mediante la actuación de los músculos inspiratorios, especialmente el diafragma, que aumenta el volumen de la caja torácica ocasionando una presión negativa dentro del espacio pleural, que se trasmite al interior del pulmón. La espiración, en cambio, es un proceso generalmente pasivo que no requiere acción muscular alguna, pues está facilitada por las propiedades mecánicas de los pulmones que tienden a retraerse y arrastran a la caja torácica hasta un punto de equilibrio.
La presión negativa intratorácica, en contraposición con la presión atmosférica, hace que la apertura de la caja torácica durante una toracotomía produzca el colapso del pulmón y la interrupción de la ventilación. Esta circunstancia impidió el desarrollo de la cirugía torácica hasta que Ferdinand Sauerbruch (4) desarrolló en 1904 una cámara de hipopresión (Fig. 16) que permitía al equipo quirúrgico y al paciente, excepto su cabeza, introducirse en la cámara para desarrollar la intervención mediante una toracotomía, sin que se colapsase el pulmón. Sólo permanecía fuera de la cámara la cabeza del paciente, así como el anestesista.

Todo este voluminoso y complejo dispositivo fue fácilmente superado cuando Meltzer y Auer en 1909 pusieron en marcha las técnicas de insuflación endotraqueal en perros (Fig. 17) y en 1910 empezaron a aplicarse en clínica humana en los Estados Unidos, y en 1912 llega a Inglaterra por Kelly, evolucionando rápidamente el progreso de la cirugía cardio-torácica.
ECMO (Oxigenador de membrana extracorpórea)
Su origen se remonta a la puesta en marcha de la circulación extracorpórea por Gibbon en 1953 (5) y ha ido evolucionando en diversos aspectos, como el diseño, la tecnología, selección de los pacientes, técnicas de inserción evolución de los dispositivos, etc. que han ampliado sus indicaciones tanto en pacientes adultos como en la infancia.
Es un sistema de asistencia mecánica circulatoria y respiratoria, capaz de proporcionar soporte cardíaco y/o pulmonar durante un periodo limitado de tiempo en situaciones de insuficiencia cardíaca (ECMO arteriovenoso) o respiratoria (ECMO veno-venoso), refractarias a un tratamiento convencional (Fig. 18).

El dispositivo cubre las necesidades tisulares de aporte de O2 y eliminación del CO2, cuando la lesión cardíaca o pulmonar sea recuperable en un corto periodo de tiempo.
En las circunstancias que aconsejan sustituir solamente la función respiratoria con la utilización del ECMO, se logra un contenido suficiente de O2 en la sangre arterial mientras que el propio paciente es capaz de mantener el gasto cardíaco.
Componentes del sistema (Fig. 19)
El circuito se compone de los siguientes elementos ensamblados en serie:
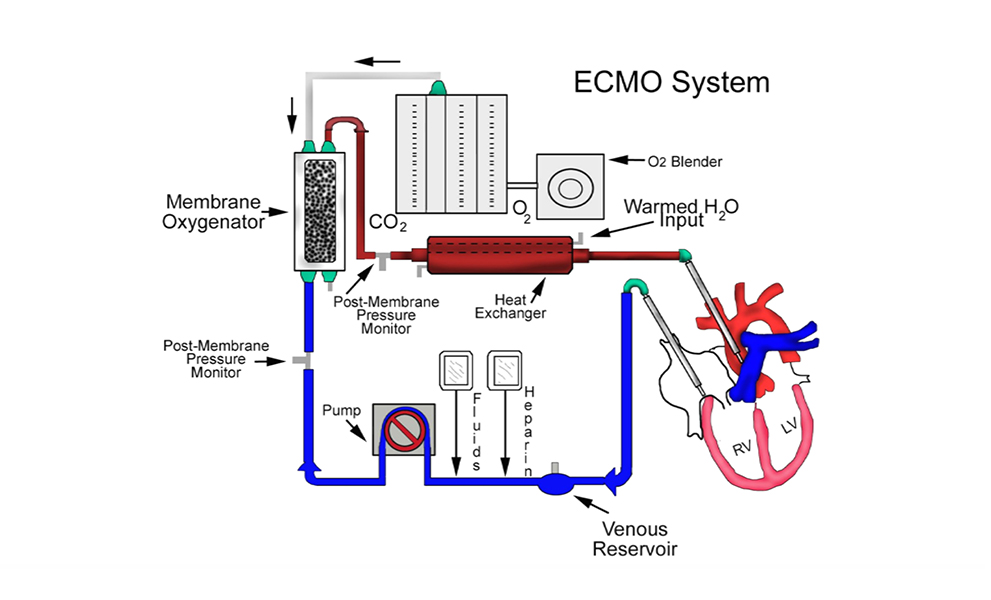
- Cánulas. Fabricadas con poliuretano, reforzadas con anillos de acero inoxidable que son radio-opacas, flexibles y resistentes al acodamiento y permiten flujos sanguíneos altos. Su tamaño se selecciona en función de la superficie corporal del paciente, y también del calibre del vaso sanguíneo que se va a canular. Siempre se intenta utilizar el mayor calibre posible para asegurar un flujo adecuado, con la menor resistencia
- Sistema de tubos, que conectan con las cánulas. Existen dos líneas, una línea venosa donde la sangre del paciente circula hacia la bomba centrífuga, y otra línea arterial que permite a la sangre llegar hasta la cánula de retorno, cuando se programa en el ECMO veno-arterial. Sin embargo, en el ECMO veno-venoso, indicado en las insuficiencias respiratorias, ambas líneas se dirigen a la circulación del corazón derecho.
- Consola. Se encarga del control hemodinámico y suministra la fuerza electromotriz a la bomba, regula la velocidad de rotación de la centrífuga, y registra la información aportada por los sensores de seguridad conectados con el circuito. Cada tipo de bomba funciona con su consola específica, informando de las revoluciones por minuto y del flujo en litros por minuto.
- Bomba centrífuga. Proporciona la energía necesaria para impulsar la sangre generando presiones negativas en la línea venosa, y presión positiva en la línea arterial que permite el retorno de sangre al paciente en ECMO arteriovenoso. Estas bombas generan flujo laminar, no pulsátil, y no son oclusivas. Modificando la precarga y la postcarga, se consigue el flujo adecuado para cada paciente
- Oxigenador de membrana. Se compone de una fase gaseosa y otra sanguínea separadas por una membrana. La transferencia de gas a la sangre, o viceversa, se realiza por difusión, movimiento de los átomos o moléculas de un gas desde las regiones con una alta concentración a las regiones de concentración más baja. Los oxigenadores utilizados actualmente permiten una larga duración sin necesidad de cambiarlo durante varias semanas, asegurando una buena oxigenación.
- Mezclador oxígeno aire. Mediante este dispositivo, se regula la proporción de oxígeno/aire y el flujo de esta mezcla de gases que entra en la fase del oxigenador. El aporte de O2 y la eliminación del CO2 son relativamente independientes. El control de la eliminación del CO2 se realiza variando el flujo de gas del mezclador. Si se aumenta el flujo de gas, también se aumenta la eliminación de CO2 porque disminuye la presión parcial del CO2 en la fase gaseosa, de manera similar a la respiración profunda del pulmón y viceversa. El control del aporte de O2 se efectúa aumentando o disminuyendo la proporción de O2 del gas suministrado por el mezclador o caudalímetro.
- lntercambiador de calor. Los oxigenadores van provistos de un serpentín por donde circula agua a una temperatura variable, permitiendo enfriar o calentar la sangre en contacto con el serpentín. La sangre que circula por el circuito va perdiendo calor a lo largo del recorrido, por lo que debe mantenerse en normotermia a 36º para evitar complicaciones del ritmo cardíaco.
Indicaciones del ECMO (7) como asistencia respiratoria (ECMO V-V)
- Pacientes con insuficiencia respiratoria grave, parcialmente reversible y con función cardíaca preservada (neumonías graves, contusiones pulmonares, estatus asmático o síndrome de distres respiratorio del adulto-SDRA-).
- Pacientes con fallo precoz del injerto después de un trasplante pulmonar.
- Pacientes en lista de espera para trasplante pulmonar, en situación de gran deterioro y con necesidad de intubación y ventilación mecánica.
De una adecuada selección de los pacientes (8), así como la elección del momento óptimo para su implantación va a depender en gran medida el resultado final del procedimiento (9,10).
La indicación del ECMO V-V suele realizarse exclusivamente como una asistencia respiratoria, pues no proporciona soporte cardíaco directamente, aunque al disminuir las resistencias pulmonares mejora la función del ventrículo derecho.
En el ECMO V-V la sangre se drena y se reinfunde en el sistema venoso del paciente, por tanto, el circuito del ECMO está conectado en serie al corazón y los pulmones, a diferencia del ECMO veno-arterial (ECMO V-A), donde funciona en paralelo. Tras oxigenarse y descarboxilarse, la sangre se reinfunde en la aurícula derecha y se eyecta a la circulación pulmonar por la propia función cardiaca del paciente. Hay varias posibilidades de configuración: canulación fémorofemoral, canulación fémoro-yugular o bien utilizar una zona sola cánula de doble luz.
En la configuración fémoro-femoral, la sangre se drena de la vena cava inferior, mediante una cánula venosa femoral y se reinfunde a través de una cánula situada en la vena femoral, normalmente contralateral, avanzada hasta la aurícula derecha. La cánula de drenaje suele ser multiperforada, con orificios laterales y en la punta, de 21 a 25 Fr, mientras que para la reinfusión se utiliza una cánula de menor calibre (17 a 21 Fr) con orificios sólo en la punta.
En la configuración fémoro-yugular, la sangre se drena de la vena cava inferior, a través de una cánula introducida desde la vena femoral, con la punta situada unos 5 a 10 cm. por debajo de la unión aurícula derecha-vena cava inferior. La sangre se reinfunde en la aurícula derecha a través de una cánula insertada en la vena yugular interna, avanzada hasta la confluencia aurícula derecha-vena cava superior. Suele ser esta configuración la técnica de elección.
Se ha diseñado una cánula de doble luz para drenar la sangre de ambas venas cavas y reperfundir la sangre ya oxigenada a la aurícula derecha, dirigiendo el flujo hacia la válvula tricúspide. La inserción de este tipo de cánulas de doble luz se hace a través de la vena yugular interna derecha. Tiene la ventaja de requerir un único punto de canulación, lo que favorece la comodidad y movilidad del paciente.
Conclusiones
Hoy día disponemos de gran variedad de dispositivos utilizados tanto como tratamiento o como prevención de compromisos respiratorios y circulatorios, en situaciones clínicas diversas. El ECMO va a ser utilizado más frecuentemente en una población más amplia y más diversamente compleja de pacientes críticos, dada su versatilidad, ya que permite tratar el fallo respiratorio, circulatorio o ambos con rapidez y facilidad de implante, escasa invasibilidad y buena relación coste-eficacia.
La canulación con una vía de doble luz y con anestesia local del ECMO V-A en casos de hipertensión pulmonar y disfunción importante del ventrículo derecho y del ECMO “ambulatorio” (vena yugular interna-arteria axilar) podrán mejorar los resultados del ECMO como soporte respiratorio.
Un abordaje multidisciplinar con anestesistas, intensivistas, cirujanos cardiotorácicos, enfermeras y otros especialistas es fundamental para el éxito del ECMO V-V y V-A.
ECMO y trasplante de pulmón (Fig. 20)
Presentamos la experiencia (11) de la Unidad de Trasplante de Órganos Torácicos, Servicios de Cirugía Cardíaca y Torácica, del Hospital Universitario Puerta de Hierro – Majada honda, Madrid, Universidad Autónoma de Madrid.

Teniendo en cuenta que la oxigenación con membrana extracorpórea (ECMO) tanto en sus formas ECMO V-A como V-V, representa una alternativa de soporte circulatorio y/o respiratorio eficaz para los pacientes que son candidatos a un trasplante pulmonar, tanto en el preoperatorio como durante el procedimiento trasplantador, así como durante el postrasplante, se consideró que sería interesante comparar los resultados tanto inmediatos como a medio plazo de los pacientes trasplantados de pulmón, que precisaron ECMO frente a los pacientes que no lo requirieron. En la casuística de 43 meses desde enero de 2015 a julio de 2018, se hicieron 145 trasplantes pulmonares aislados, además de 8 trasplantes del bloque cardiopulmonar que no se incluyeron en el estudio.
De esta serie de 145 trasplantes, en 117 ocasiones (80,7%) se realizó trasplante bipulmonar y en los restantes 28 (19,3%) trasplante unipulmonar.
El ECMO, en sus formas veno-venoso o veno-arterial tanto durante los periodos pre, intra o post trasplante hubo necesidad de utilizarlo en 51 pacientes, que representa el 35 % de la serie, mientras que en 94 (65%) no se utilizó.
La mortalidad global precoz fue del 11% (16 de 145 trasplantados), aunque hay que señalar que en los trasplantes que no necesitaron ECMO fue de 5 casos en 94 pacientes, lo que representa el 5,3%. En contraposición, la mortalidad en los pacientes que necesitaron la ayuda del ECMO fue bastante más elevada (11 de 51 pacientes, es decir el 21,6%). Sin embargo, la supervivencia a medio plazo (3,2 años) fue similar en los dos grupos (ECMO vs. no ECMO, p=0.08).
Respecto al grado funcional previo y postrasplante de pulmón (NYHA), el 79,3% de los pacientes se encontraban en grado 111 y IV preoperatoriamente, mientras que en el postrasplante, el 83% de los pacientes pasaron a encontrarse en grado I y 11 de la NYHA.
Este seguimiento permitió sacar las siguientes conclusiones:
- La indicación del ECMO estuvo condicionada a aumentos de la presión media pulmonar superiores a 54 mm de mercurio.
- La mortalidad hospitalaria fue significativamente mayor en los pacientes que precisaron ECMO, situación relacionada con la peor condición clínica de estos enfermos.
- Tras superar el periodo postoperatorio hospitalario, la calidad de vida y la supervivencia a medio plazo fueron semejantes en los pacientes que requirieron ECMO como en los que no lo precisaron.
- El ECMO representa una alternativa segura y eficaz como soporte respiratorio y/o circulatorio en determinados pacientes sometidos a un trasplante de pulmón.
RESPIRACIÓN O VENTILACIÓN LÍQUIDA
La respiración líquida es una técnica, todavía experimental, aunque asistamos ya a una fase iniciática de aplicación clínica, de ventilación mecánica en la que los pulmones se insuflan con un líquido perfluoroquímico oxigenando más que con una mezcla de gas y oxígeno.
La utilización de los perfluorocarbonos (PFCs) o perfluoroalcanos en su denominación más actual, una familia de compuestos derivadas del hidrocarburo donde los átomos de hidrógeno han sido reemplazados por átomos de flúor, ofrece ventajas en el tratamiento del daño pulmonar agudo superando al hidrógeno como transportador de O2 y CO2, incluyendo:
- Reducción de la tensión superficial, manteniendo un fluido intercambio (interface) con los alveolos.
- Abriendo los alveolos colapsados por presión hidráulica, con bajo riesgo de barotrauma.
- Proporcionando un reservorio en el que el O2 y el CO2 pueden intercambiarse con la sangre de los capilares pulmonares.
- Funcionando como un eficiente intercambiador de calor.
Antecedentes históricos
Desde hace 350 millones de años, los peces han respirado líquidos a través de las agallas. Los mamíferos desarrollaron los pulmones para respirar aire. Raramente ocurren circunstancias en las que un mamífero necesita retrasar su reloj biológico para respirar a través de un medio líquido (12). Esta situación es particularmente cierta si la tensión superficial de la fase líquido-aire en el pulmón se incrementa, como ocurre en una lesión pulmonar aguda: se daña el surfactante pulmonar provocando el colapso alveolar, atelectasia, aumento del shunt derecha-izquierda y la hipoxemia.
Con este tercer concepto, el trabajo de von Neergard (13) demostró que la presión necesaria para expandir un pulmón lleno con aire es casi tres veces mayor que la requerida para distender un pulmón relleno de líquido.
Clark y Gollan (14), en 1966, observaron la posibilidad de mantener a los animales de experimentación totalmente sumergidos en medios oleosos saturados de O2 (Fig. 21, rata de Clark).

Shaffer y cols (15), en 1976 reportan la primera ventilación líquida (VL) en corderos pretérminos.
Después de la Primera Guerra Mundial, las investigaciones para el tratamiento de la inhalación de gases venosos se llevó a cabo utilizando soluciones salinas aplicadas a pulmones, experimentalmente en perros. También contemporáneamente se estudió la respiración en medio líquido para aumentar las posibilidades de escapar desde las profundidades oceánicas en un submarino sumergido.
Para suministrar suficiente cantidad de O2 disuelto en la solución, los animales fueron sometidos a incrementos progresivos de la presión, en algunas ocasiones, por encima de las 160 atmósferas, que es la presión existente una milla por debajo de la superficie del mar. Sin embargo, el trabajo respiratorio era muy grande y los animales morían en pocos minutos con acidosis respiratoria.
Por tanto, el líquido respirable para una utilización práctica debería disolver una gran cantidad de gases respiratorios a presión atmosférica. Relativamente hay pocos agentes que tengan estas propiedades, esencialmente tan solo los aceites de silicona y los PFCs. Cuando se comprobó que los aceites de silicona eran tóxicos, tan solo los PFCs resultaron susceptibles de ser utilizados.
Propiedades fisicoquímicas de los perfluorocarbonos (PFCs).
Los PFCs fueron producidos por primera vez durante la Segunda Guerra Mundial como parte del Proyecto Manhattan. Sus propiedades dependen de la unión de los átomos de F-C. Estas propiedades hacen de estos compuestos sustancias inertes, incoloras, inodoras, transparentes, no metabolizables ni transformables, insolubles en agua y débilmente solubles en lípidos.
Su utilidad para la ventilación mecánica depende de su capacidad para disolver 20 veces más O2 y 3 veces más CO2 que el plasma, evaporándose más rápidamente que el agua a temperatura corporal. Los PFCs no se metabolizan, eliminándose predominantemente por volatilizacion pulmonar junto con los gases respiratorios, y en muy escasa cantidad, se transpiran por la piel.
Entre otras aplicaciones, también han sido aprobados para aplicaciones biomédicas como transportadores de O2, aplicados intravenosamente en situaciones de desastres, o como sangre sintética artificial en individuos que rechazan ser transfundidos, como los Testigos de Jehová, y también como sustituto del líquido de las cámaras oculares, o bien como agentes radiológicos de contraste inertes, con escasos riesgos de producir reacciones alérgicas.
Experiencia clínica
Greenspan y col. (17) presentaron la primera experiencia de VL en humanos en una investigación realizada en neo natos. Posteriormente, Gauger y cols.(18) informaron de una experiencia en seis pacientes pediátricos con síndrome de distres respiratorio agudo (SDRA). Hasta la fecha se han desarrollado estudios clínicos usando ventilación líquida parcial (VLP) con PFCs en neonatos con DRS y en adultos, y niños con SDRA. El razonamiento para usar VLP en esta población consiste en aumentar el reclutamiento alveolar, incrementando la inflamación del pulmón, mejorando el intercambio de gases y distensibilidad pulmonar, y minimizando el daño inducido por el ventilador.
Más recientemente Leach ha publicado resultados de la eficacia de la VLP en 13 niños prematuros con DRS, tras haber fallado el tratamiento convencional, incluyendo surfactante. 10 niños recibieron VLP durante 24 a 76 horas, en otros 3 el tratamiento fue interrumpido a las 4 horas, favoreciendo otras modalidades de ventilación mecánica. Después de una hora de instilación del PFC, la oxigenación de los pacientes aumentó en un 138% y la distensibilidad mecánica en un 61%. La fracción inspirada de oxígeno (FiO2) se redujo a menos del 30% en un periodo de 24 horas, y el CO2 se normalizó a las 4 horas. 8 de los 13 niños, incluyendo dos que se retiraron del estudio, sobrevivieron a una edad gestacional corregida de 36 semanas. 3 niños podían respirar aire ambiental y 4 requirieron O2 suplementario a flujo bajo, pudiendo suspenderse la oxigenoterapia a los 60 días. Todos los niños tuvieron valores significativos de PFC en sangre después de 4 horas de VLP, y a las 24 horas. De 20 a 28 días después de la última dosis los neonatos aún tenían valores sanguíneos de PFC de 2 mg/ml. y las radiografías de tórax aún evidenciaban algún componente residual (Fig. 22, A, B, C, D). Estos datos indican que en esta población de pacientes, la VL es inocua y produce una significativa mejoría de la oxigenación.
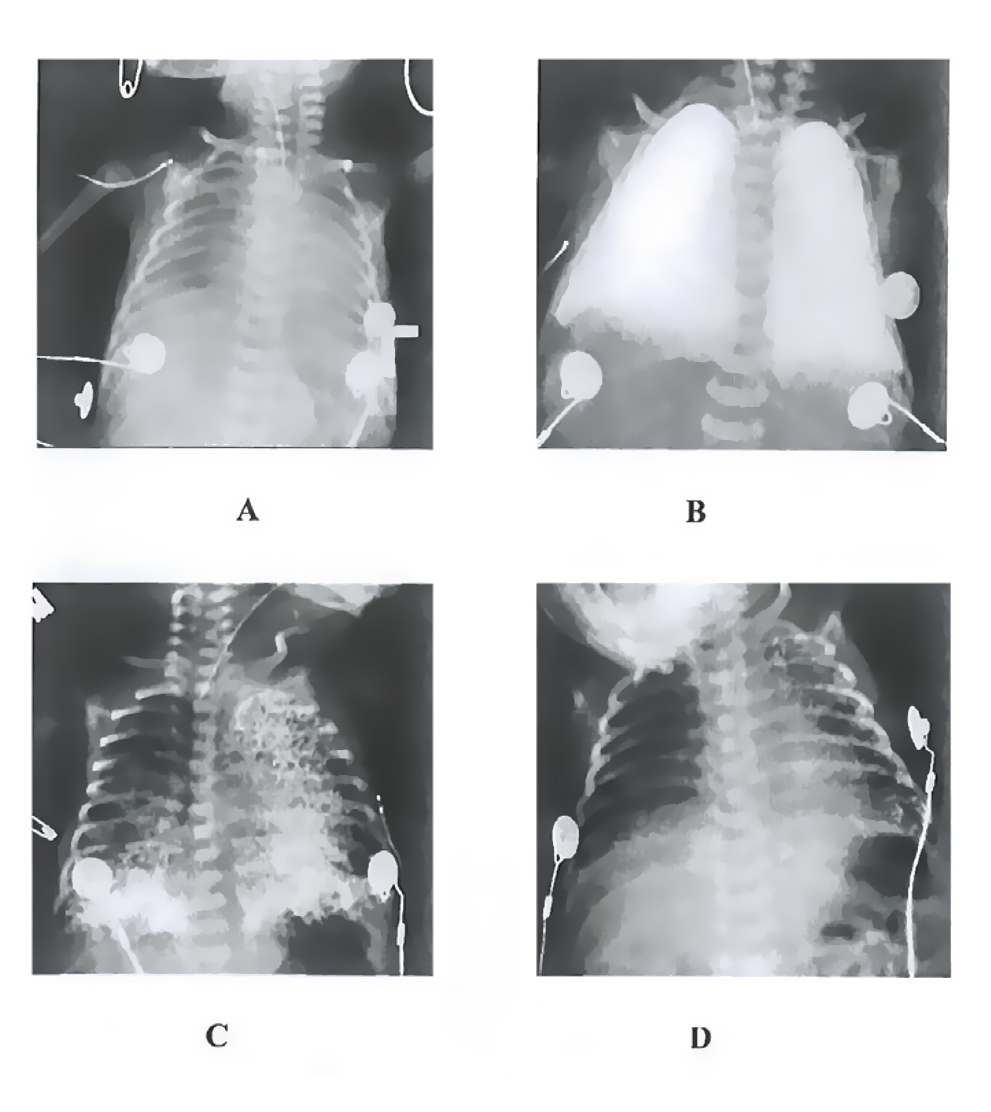
A: Antes de iniciar la insticación de PFC
B: 1 hora después de instilado el PFC
C: 48 horas después de instilado el PFC
D: 1 semanas después de la instilación de PFC
Las publicaciones en adultos han demostrado que la VLP es bien tolerada, mejora la oxigenación y disminuye la FiO2(19). En relación con los neonatos, requieren dosis mucho mayores de PFC, y no suele ser posible obtener una distribución homogénea del compuesto en los pulmones. El PFC se administró en la tráquea hasta que las zonas por gravedad, en los pulmones, estuvieron llenas y fue reemplazado debidamente entre el 1 er y 7º días, con una dosis total promedio de 38 ml./kg. Los pacientes tuvieron una disminución significativa del shunt fisiológico, mejoría de la distensibilidad estática y una supervivencia del 50%. Como complicaciones, se detectó en un paciente neumotórax, y en otro impactación mucosa significativa. El PFC pudo detectarse en las radiografías de tórax hasta 138 días después de ser administrado. Tiene la ventaja de aumentar la visibilidad del neumotórax, pero dificulta la evaluación de la enfermedad pulmonar, así como la localización de los catéteres intratoracicos.
Conclusiones
Los PFCs tienen excepcionales propiedades para propiciar el intercambio gaseoso y mecanismos respiratorios alternativos, con efectos beneficiosos en traumatismos pulmonares agudos. En el momento actual no hay evidencia de que en algunos tipos de pacientes con SDRA puedan responder favorablemente al tratamiento con PFC. Otras formas de administración, como aerosoles o vaporización, pueden tener ciertas ventajas:
- El uso de VLP con PFC en neonatos, niños y adultos con daño pulmonar agudo/SDRA, se asocia a una mejoría en el intercambio de gases y en la mecánica pulmonar.
- La interacción cardiopulmonar y los efectos de toxicidad a largo plazo necesitan de estudios más amplios, aunque las extrapolaciones de los datos en animales sugieren que no hay efectos indelebles a largo plazo.
- La información disponible indica que se requiere monitorización continua y ajuste de los parámetros del ventilador durante la instilación del medicamento, para reducir la hipoxemia, las complicaciones hemodinámicas y la aparición de neumotórax.
- Se necesitan más estudios clínicos para explorar la eficacia de la VLP en el daño pulmonar agudo/SDRA, particularmente para evaluar los efectos tóxicos a corto y medio plazo, la eficacia de dosis menores, las diferentes estrategias de ventilación mecánica y la evaluación a largo plazo.
- Se requiere, sin duda, investigación adicional incluyendo grandes grupos comparativos para responder a estas y otras preguntas.
AGRADECIMIENTOS
Al profesor Raúl Burgos Lázaro por su amable colaboración documental e iconográfica.
BIBLIOGRAFÍA
- Téllez de Peralta G. Asistencia mecánica circulatoria. Anales RANM 2018; 135 (1): 31-39.
- Téllez de Peralta G. Asistencia mecánica circulatoria 11. Ventrículos artificiales. Anales RANM 2019; 136 (2): 158-166.
- Planas A. Reanimación cardiopulmonar. En: Tratado de Cirugía Cardiovascular. Téllez de Peralta, G (editor). Madrid: Díaz de Santos, 1998. pp. 32-39.
- Goerke H. 300 años de historia de la medicina. De Hipócrates a la medicina bioquímica. Cámara baja de presión de Sauerbruch. Barcelona: Gustavo Gili, 1986. pp. 257-258.
- Doñate Bertolin L, Torregrosa Puerta S, Montero Argudo IA. Asistencia mecánica circulatoria de corta duración. Cir Cardiov 2016; 23 (5): 26-40.
- García Asenjo M, Kesare Eguren G. Soporte vital extracorpóreo. Oxigenación por membrana extracorpórea. ECMO. Rev Esp de Perfusión 2017 (ler semestre); 5-26.
- Strickland R, Frantzis P. Royal Adelaide Hospital. General ICU. ECMO Guideliness. 2009; 1-47.
- Makdisi G, 1-Wen Kang. Extracorporeal membrane oxygenation (ECMO) review of a lifesaving technology. J Thorac Dis 2015; 7 (4): 166-176.
- Rupprecht 1, Lunz D, Philipp A, Lubnov M, Schmid C. Pitfalls in percutaneous ECMO cannulation. Heart Lung Vessels 2015; 7 (4): 320-326.
- Banfi C, Pozzi M, Brunner M, et al. Vena-arterial extracorporeal membrane oxygenation: An overview of different cannulation techniques. J Thorac Dis 2016; 8 (9): e875-e885.
- Burgos Lázaro RJ, Sánchez Calle A, Romero Román A, Burgos Frías N, Rivas Ollarzábal J, Campo Cañaveral JL, Varela de Ugarte A, Forteza Gil A. ECMO y trasplanta de pulmón. Comunicación personal.
- Kaisers U, Kelly KP, Busch T. Liquid ventilation. Br J Anaesth 2003; 91: 143-151.
- Van Neergard K. Neue auffassungen bei einem grundbegriff der atemmechanik; die retraktionskiaft der lungin abhangig van oberflachungs panning in den alveolen. Gesarnte Exp Med 1929; 66: 373-394.
- Clark LC, Gallan F. Survival of mammals breathing organic liquids equilibrated with oxygen at atmospheric pressure. Science 1966; 152: 1755-1766.
- Shaffer TH, Rubenstein D, Moskowitz D, Delivoria – Papadopoulus M. Gaseosus exchange and acid-base balance in premature lambs during liquid ventilation since birth. Pediatr Res 1976; 10: 227-231.
- Anzueta A, Mela J, Caviedes l. Ventilación líquida. Med Intensiva 2001; 25: 200-206.
- Greenspan JS, Wolfsen MR, Rubenstein SD, Shaffer TH. Liquid ventilation of human preterm neonates. J Pediatr 1990; 117: 106-111.
- Gauger PG, Pranikoff T, Schreiner RJ, Moler FW, Hirsch! RB. lnitial experience with partial liquid ventilation in pediatric patients with acute respiratory distress syndrome. Crit Care Med 1996; 24: 16-22.
- Hirchl RB, Pranikoff T, Wisec C, et al. lnitial experience with partial liquid ventilation in adult patients with the acute respiratory distress syndrome. J Am Med Assoc 1996; 275: 383-389.
DECLARACIÓN DE TRANSPARENCIA
El autor/a de este artículo declara no tener ningún tipo de conflicto de intereses respecto a lo expuesto en la presente revisión.
ranm tv
Gabriel Téllez de Peralta
Real Academia Nacional de Medicina de España
C/ Arrieta, 12 · 28013 Madrid
Tlf.: +34 91 159 47 34 | E-Mail: Email de correspondencia
Año 2020 · número 137 (01) · páginas 10 a 21
Enviado*: 21.01.20
Revisado: 30.01.20
Aceptado: 20.02.20
* Fecha de lectura en la RANM


