Resumen
El estudio de la patología asociada a infección por COVID-19 está mostrando alteraciones histológicas semejantes a otras infecciones asociadas a pandemias previas, como el daño alveolar difuso, signos de endotelitis, infiltrados inflamatorios y micro trombos de fibrina. En las muestras de pacientes con COVID-19 destaca un mayor número de casos con signos de endotelitis y mayor número de micro trombos, tanto a nivel del parénquima pulmonar como en otras localizaciones, como colon, miocardio, hígado…Se comentan las diversas alteraciones descritas hasta junio 2020.
En el estudio de las biopsias de pacientes con secuelas post-COVID se está observando infiltrados inflamatorios intersticiales a nivel de pulmón y áreas de fibrosis. Se están estudiando diversos factores que puedan predecir la mayor o menor probabilidad del desarrollo de fibrosis pulmonar en dichos pacientes.
Abstract
The experience of recent months in the study of the pathology associated with COVID-19 infection is showing histological alterations similar to other infections associated with previous pandemics, such as diffuse alveolar damage, signs of endotheliitis, inflammatory infiltrates and fibrin microthrombi. In the samples of patients with COVID-19, a greater number of cases with signs of endothelitis and a greater number of microthrombi stand out, both at the level of the lung parenchyma and in other locations, such as the colon, myocardium, liver …
The study of the biopsies of patients who have overcome the acute phases of COVID is showing the presence of interstitial inflammatory infiltrates at the lung level and areas of fibrosis, and various factors that may predict the greater or lesser probability of the development of fibrosis are being studied pulmonary in such patients.
Palabras clave: COVID-19; SARS CoV-2; Pulmones patología; Micro trombos; Vasculitis.
Keywords: COVID-19; SARS CoV-2; Lung pathology; Microthrombos; Vasculitis.
INTRODUCCIÓN
En diciembre del 2019 una serie de pacientes afectos de neumonía de causa desconocida aparecieron en Wuhan, Hubei, China. El análisis de las muestras del tracto respiratorio inferior demostró la presencia de un coronavirus que se denominó SARS CoV-2.
La afectación por COVID 19 o SARS CoV-2 tiene 3 estadios consecutivos de afectación y gravedad clínica. El primer estadio se caracteriza por la infección por el virus, con síntomas semejantes a los de la gripe, posteriormente los pacientes pueden desarrollar neumonía viral y pueden requerir hospitalización y ventilación mecánica. El segundo estadio se caracteriza por una inflamación pulmonar más marcada y por coagulopatía. Además hay aumento de los niveles de interleuquinas, como la interleuquina 6, la interleuquina 1, y la proteína C-reactiva, de la ferritina y del D-dímero. Suelen asociarse con el desarrollo del síndrome de distrés respiratorio agudo. Finalmente el tercer estadio se caracteriza por la fibrosis. (1-7)
El SARS CoV-2 se integra en células con el receptor ACE2 y los niveles más altos de expresión de dicho receptor son en intestino, riñones y testículos (8). También se observa una expresión moderada a nivel del corazón, y menor a nivel de los pulmones, vasos e hígado. El virus se integra a través de dicho receptor y con participación de otras moléculas como el TMPRSS. El virus, tras su internalización en la célula, se replica generando cientos de copias. Durante la síntesis de copias virales, se producen alteraciones de vías bioquímicas celulares, que incluyen los genes RHIM y RIPK3, que, activando una serie de vías celulares y de caspasas, llevan a la célula a la muerte vía los mecanismos de necroptosis y de pyroptosis.
Es interesante que la muerte celular por pyroptosis, que es una muerte celular programada, sea diferente a la apoptosis que vemos en alteraciones fisiológicas y tras tratamientos oncológicos. Citológicamente se observa alteración de la membrana celular, tumefacción celular e inflamación, a diferencia de la apoptosis clásica, que solamente se acompaña de histiocitos (9,10).
El SARS CoV-2 se puede detectar en muestras tisulares por diversas técnicas. En primer lugar, por la técnica de PCR en tiempo real, que nos permite una sensibilidad muy alta, y también en secciones histológicas con técnicas de immunohistoquímica para la detección de las proteínas virales, de la cápside y de las espículas, así como técnicas de hibridación in situ para distinguir en qué células se ha integrado el virus. Asimismo, se están realizando estudios de microscopía electrónica con resultados positivos a nivel de pulmón, endotelios e hígado. (Figura 1)
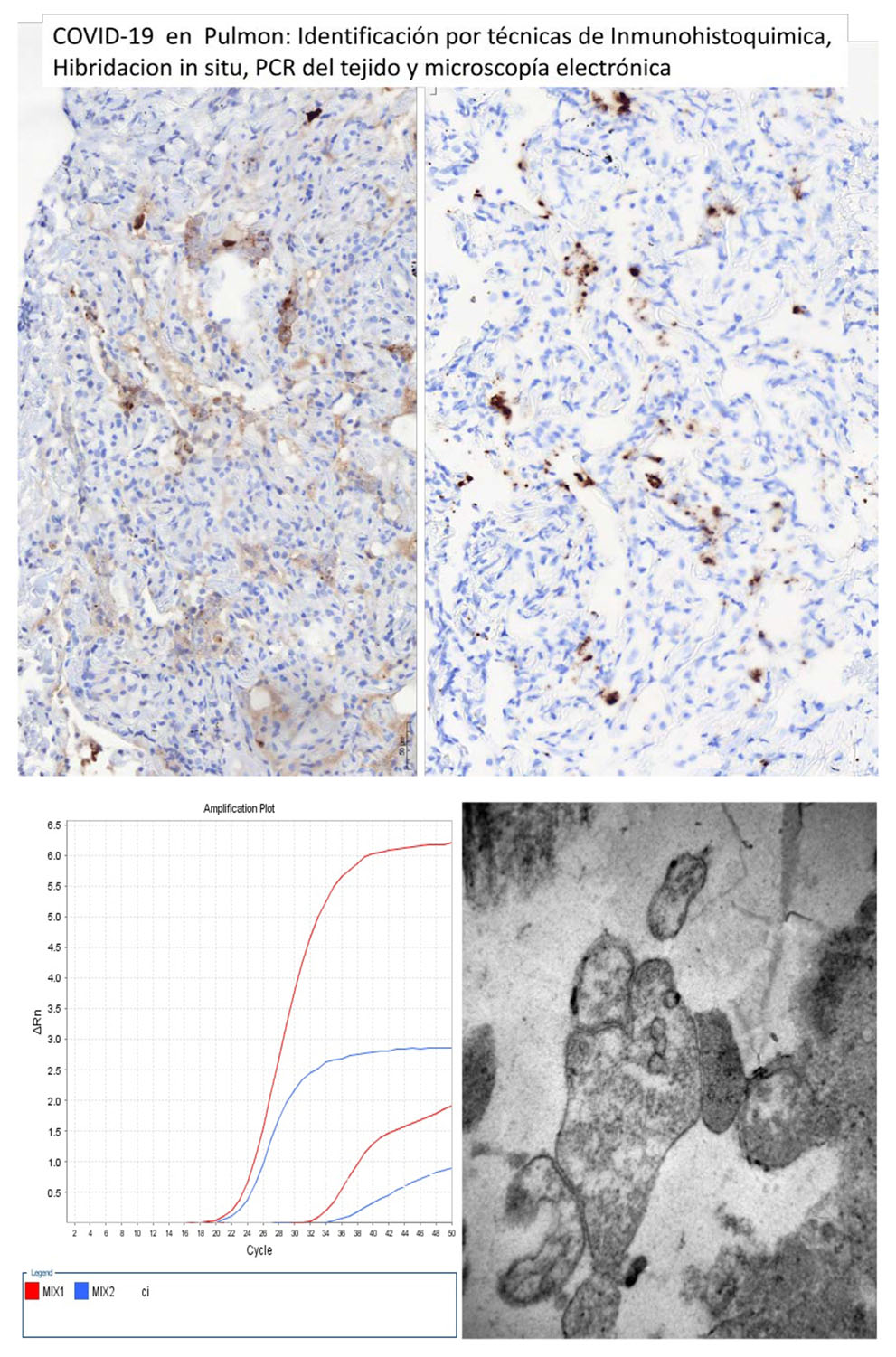
LA PATOLOGÍA PULMONAR
Con la COVID-19, en primer lugar, a nivel del pulmón se observa una patología heterogénea con una afectación que muestra diversos patrones histológicos y variabilidad según el tiempo de evolución y gravedad de la enfermedad. Es habitual el observar diferentes patrones tisulares a nivel de las muestras obtenidas, patrones que consisten básicamente en la presencia de un daño alveolar difuso, de focos de fibrosis y de infiltrado inflamatorio. El daño alveolar difuso se traduce en la presencia de membranas hialinas que tapizan los alveolos con descamación de neumocitos e histiocitos a las luces alveolares. Se puede acompañar de fibrina, así como de infiltrado inflamatorio a nivel septal e intersticial. En algunos casos predomina la exudación de tipo neumónico con presencia de fibrina y leucocitos polimorfonucleares a nivel de las luces alveolares y en ocasiones con abundantes acúmulos de neutrófilos (Figura 2). Estas fases iniciales, más de tipo exudativo, a lo largo de los días se va organizando y como sucede en otras neumonías virales o secundarias a cualquier distrés respiratorio, se pueden organizar formando focos de neumonía en organización, así como eventualmente evolucionar a áreas de fibrosis.
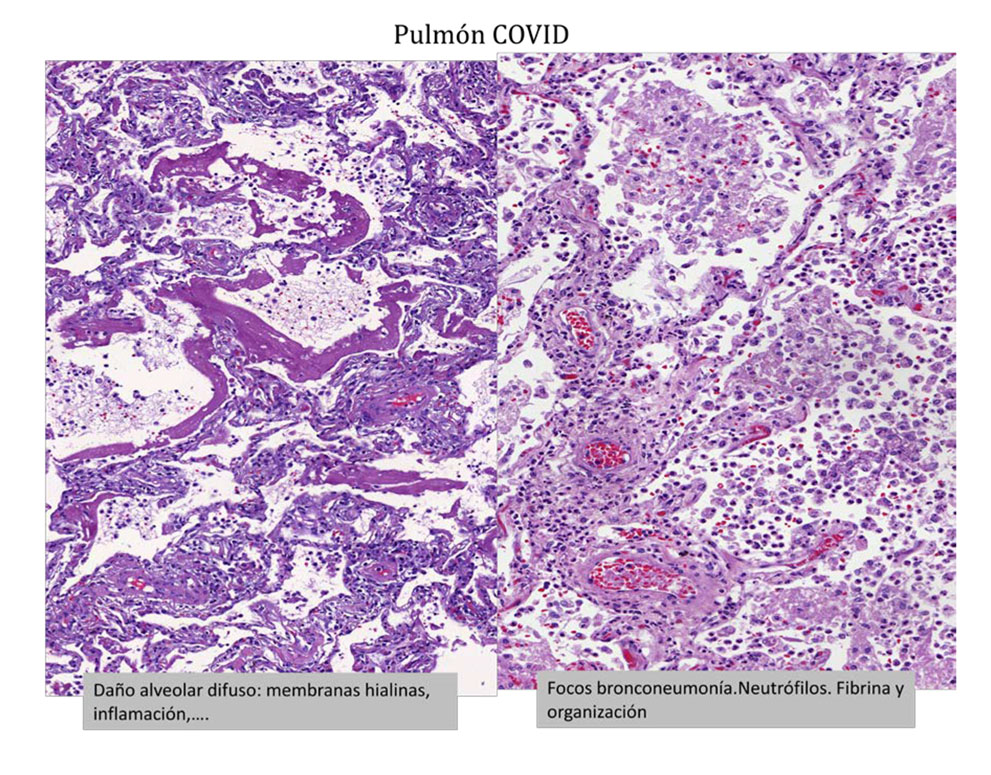
En la mayoría de las muestras se han identificado micro trombos de fibrina a nivel de los capilares y vasos de pequeño tamaño, que no es patognomónico de la infección por el COVID, pero sí que se ve con más frecuencia que en otras neumonías virales o de etiología infecciosa. (1, 2, 7, 11, 12, 13). (Figura 3)

También en las muestras de COVID, se pueden observar células gigantes multinucleadas a nivel de los septos y desprendidas de las luces alveolares, fenómeno que también se puede observar en otro tipo de neumonías virales. Por último, de forma inespecífica, pero que se observa con gran frecuencia, es la marcada congestión vascular a nivel del parénquima pulmonar que, según algunos autores, puede constituir un hallazgo bastante característico. (13,14)
En un resumen de la mayor parte de los casos descritos en la literatura (7) destaca la afectación pulmonar en los estudios autópsicos de adultos en el 88% de los casos, marcada congestión y edema pulmonar en el 83% de los casos, cambios hemorrágicos en el 22%, y émbolos macroscópicos en torno al 10% de los casos.
Los síntomas y la afectación epitelial se desarrollan desde los primeros días y suele disminuir a partir de los 28 días del comienzo de los síntomas. El patrón de fibrosis de pulmón se ha podido observar desde las 3 semanas desde el comienzo de los síntomas y en un número relevante de casos, en las 2 primeras semanas, reflejando probablemente patología previa de los pacientes. (Figura 4)

A semejanza de lo descrito en nuestros hallazgos, en la literatura (15) se describen como alteraciones más frecuentes las siguientes: el daño alveolar difuso con membranas hialinas en el 75% de los casos, la descamación neumocitaria e hiperplásica reactiva en el 70%, la presencia de células gigantes multinucleadas en el 20%, cambios citopáticos virales y/o cuerpos de inclusión en torno al 20%, yemas fibrosas intraalveolares en el 2%; a nivel vascular: congestión vascular en más del 40%, micro trombos en torno al 40%, hemorragia alveolar 30%, proteinosis alveolar 25%, exudados fibrinosos intraalveolares en el 25%, y cambios capilares, incluyendo proliferación, engrosamiento y fibrina en el 25% de los casos. El infiltrado inflamatorio peri e intravascular se ha observado en torno al 10% de los casos. Por último, a nivel del estadio de fibrosis, cambios de fibrosis intersticial, con hiperplasia de fibroblastos, depósitos de colágeno septal en más del 30% y un patrón en panal de abeja en el 7%, hallazgos como infiltrado inflamatorio intersticial o intraalveolar en más del 60%, y edema intersticial e intraalveolar en torno al 50% de los casos.
LA PATOLOGÍA EN OTROS TEJIDOS
A nivel de las biopsias hepáticas que hemos podido estudiar, se ha observado focos de esteatosis y de microesteatosis y un leve-moderado infiltrado inflamatorio a nivel portal, y de forma focal a nivel lobulillar (6). En dos de los pacientes se observaron focos de microabscesos e histiocitos con hemofagocitosis La hemofagocitosis es un signo de activación monocitaria, que suele asociarse a etiología viral. En una revisión bibliográfica de 44 pacientes fallecidos (7) se ha observado: Daño hepático preexistente en 18 casos, 4 de cirrosis y 14 con esteatosis. A nivel microscópico el hallazgo más frecuente fueron la esteatosis leve o moderada y focos de necrosis parcheada, hiperplasias de células de Kupfer y dilatación sinusoidal
En varios pacientes se han realizado biopsias de intestino destacando un caso de colitis isquémica. A nivel de las muestras recibidas se observó necrosis de la mucosa y submucosa en amplias áreas del intestino delgado y del colon, y especialmente la presencia de micro trombos de fibrina a nivel de vasos de la lámina propia y de la submucosa.
A nivel renal, si bien un alto porcentaje de pacientes con COVID-19 presenta elevación de enzimas de citolisis o disfunción renal, no hay datos sobre cuál es el mecanismo histopatológico asociado, incluyendo la posibilidad de que se deba a daño citotóxico por la propia presencia del virus a nivel de los hepatocitos o del túbulo renal (8). A nivel de las biopsias de riñón estudiadas, no se han observado cambios relevantes, salvo alguna biopsia con un mínimo infiltrado inflamatorio a nivel intersticial. En una revisión bibliográfica de 62 pacientes fallecidos (7) se ha observado: grados variables de daño tubular agudo en el 65% de los casos, especialmente en túbulos proximales. Cambios achacables a alteraciones preexistentes, como arterioesclerosis en el 70%, y signos de glomérulo esclerosis benigna en el 8%. Infiltración y fallo de túbulo intersticial fue encontrada en 6 pacientes pero no signos de tubulitis. Microtrombos de fibrina en el 10% de los casos, así como dilatación y congestión glomerular en el 10% de los casos. Endotelitis linfocítica en el 2% de los casos.
A nivel cardiovascular, en una revisión de 51 casos (7) se ha reportado un infiltrado inflamatorio de células mononucleadas en 9 casos y signos de miocarditis linfocítica en 2 casos, así como endotelitis en otros 2 casos. En la mayoría destacaban daños preexistentes como hipertrofia miocardial, ateroesclerosis y fibrosis intersticial general cardiaca.
En relación con la patología en edad pediátrica, en Vall d’Hebron hemos estudiado un explante de un trasplante cardiaco realizado a un niño, tras superar el COVID, corazón en el que no se pudo observar la presencia del virus ni alteraciones inflamatorias que se pudieran asociar al mismo y en líneas generales, en los niños se está observando una patología respiratoria en torno al 30-35% de los casos (bastante menor que en los adultos), patología cardiaca con disfunción del ventrículo izquierdo en la mayoría de los niños, patología digestiva en más del 80% de los casos, así como rash cutáneo en torno al 50-60%, linfadenopatías en torno al 60% y conjuntivitis en casi el 90% de los niños (16).
A nivel de patología cerebral, el resumen de la situación de 21 pacientes (7) reveló que no había alteraciones en 16 casos. En uno de ellos había hemorragias subaracnoideas, y 2 tenían hidrocéfalos con daño hipóxico agudo y en piel se han observado lesiones inflamatorias de predominio vascular, con diagnósticos de vasculitis linfocitaria y de vasculitis leucocitoclástica. En diversos trabajos se han descrito numerosas lesiones cutáneas (17).
EL INFILTRADO INFLAMATORIO
El infiltrado inflamatorio que observamos en las muestras recibidas está constituido predominantemente por células linfoides T, CD4 y CD8, y en menor número por CD7. Células CD25 (T reguladoras) se observan en número variable. El porcentaje de células linfoides B CD20 es bajo. Del resto del componente inflamatorio, es llamativo el porcentaje de mastocitos que observamos asociado a las áreas inflamatorias en las muestras de pulmón y de otras localizaciones. Hay múltiples revisiones (10).
LA PATOLOGÍA ENDOTELIAL
Como se ha comentado anteriormente, y ya hay múltiples publicaciones al respecto, en las muestras de biopsias de pacientes con COVID se suelen observar signos de vasculitis o endotelitis. Dicha afectación se refleja en la mayoría de los casos con la asociación con micro trombos de fibrina y con infiltrado inflamatorio a nivel del endotelio y de adventicia (Figura 3). Dicho infiltrado inflamatorio suele ser de células linfoides T, con ocasionales leucocitos neutrófilos y mastocitos. En alguna publicación han señalado la presencia de partículas virales en células endoteliales por microscopía electrónica, immunohistoquímica e hibridación in situ. En relación con la patología vascular destaca el trabajo de algunos grupos que resaltan la importancia de la congestión, así como de una presumible angiogénesis, observada con microscopia de barrido ilustrando conos de crecimiento vasculares. (11, 18)
En nuestras muestras, en Vall d’Hebron, por microscopía electrónica observamos la presencia de micro trombos de fibrina, así como alteraciones endoteliales en forma de protrusiones irregulares de la pared y la presencia de múltiples organelas/vacuolas a nivel del citoplasma. Dichos signos pueden estar relacionados con pyroptosis celular incipiente pero su interpretación está por definir.
SECUELAS POST-COVID
Aun no se sabe con exactitud las secuelas que pueda dejar la afectación de COVID en los diferentes órganos, especialmente en el pulmón. Por experiencias de pandemias previas por virus, la misma familia SARS o del virus influenza, se sabe que hay un porcentaje relevante de pacientes que tras neumonías pueden evolucionar a fibrosis pulmonares. En este sentido, en nuestro hospital ya se han realizado biopsias a más de 10 pacientes en el primer mes de seguimiento, observando en 6 neumonía organizativa con cuerpos de Masson en diferentes estadios, en 1 de ellos neumonías de tipo eosinofílico que han respondido a corticoides. En los otros se observan focos de aumento de intersticio, infiltrado inflamatorio disperso e irregular, Todos estos hallazgos se están estudiando y validando con el seguimiento clínico, con objeto de intentar identificar factores que puedan predecir una evolución a fibrosis a medio plazo. También es presumible que la patología vascular del COVID, y su grave lesión endotelial, pueda conllevar secuelas en los pacientes en diferentes localizaciones.
Estudios en marcha en el Servicio de Patología Vall d’Hebron
En las muestras de los pacientes fallecidos, así como en las biopsias por seguimiento, se está estudiando la presencia de virus por microscopía óptica y ultra estructural. Los hallazgos descritos hasta la fecha son semejantes a otros publicados en la literatura por grupos de Italia, Suiza, Inglaterra, EEUU y China.
En los estudios realizados hasta el 15 de junio se ha podido detectar la presencia del virus por PCR en muestras tisulares de los pacientes fallecidos así como en varios pacientes en seguimiento y con persistencia de la afectación pulmonar.
Asimismo, se están valorando factores que puedan asociarse a una mayor probabilidad de desarrollar fibrosis pulmonar, asociados con la senescencia celular, angiogénesis y con la inducción de la fibrogénesis. La valoración conjunta del componente vascular, con marcadores de angiogénesis linfática y vascular, del grado de congestión vascular, y de factores asociados a senescencia puede ayudar a perfilar subgrupos de pacientes con mayor probabilidad de desarrollar fibrosis pulmonar. En este contexto, el papel de los mastocitos, (descritos en otras pandemias previas de SARS e influenza), puede ayudar a entender la gran cascada de citoquinas descrita en los pacientes más graves.
DISCUSIÓN
En relación con la patología pulmonar, las alteraciones descritas en pacientes con COVID-19 son heterogéneas e incluyen signos de neumonitis con afectación epitelial vascular y cambios fibróticos, con una progresión en estadios más o menos definida. No obstante, los cambios epiteliales, incluyendo el daño alveolar difuso, se pudo observar en todas las fases de la enfermedad, los cambios vasculares con los microtrombos y depósitos fibrinosos intraalveolares eran más frecuentes a nivel de fases iniciales. La afectación vascular era más prominente en el COVID que la afectación por otros SARS, el ARDS e Influenza, así como el mayor número de trombosis. Las alteraciones descritas previamente en las otras pandemias (15), con el ARDS también se observaba neumonía intersticial aguda con edema y daño alveolar difuso. En los fallecidos por neumonitis por Influenza también incluían trombosis de capilares y vasos de pequeño tamaño, edema intersticial, así como infiltrado de neutrófilos y linfoplasmocitario con grados variables de daño alveolar difuso.
Entre los principales hallazgos patológicos en otros órganos y tejidos, destacar que la presencia del virus COVID-19 ha sido detectada en corazón, hígado, riñones, tracto gastrointestinal, bazo, ganglios linfáticos, piel y placenta. Generalmente los hallazgos patológicos observados fueron no específicos, y alteraciones epiteliales con ulceración e infiltrado inflamatorio más grave se observaba en estadios avanzados de la enfermedad. Signos de micro trombos y endotelitis también se observaron en corazón, hígado riñones, tracto gastrointestinal, piel, glándula suprarrenal y próstata, reflejando probablemente un estado auto-inmune sistémico. La afectación y presencia del virus a nivel del sistema nervioso, aunque ha sido detectado por PCR en varios pacientes, no ha sido corroborado por técnicas de detección in situ en secciones tisulares hasta el momento.
Por tanto, el estudio de las alteraciones patológicas y el contexto inflamatorio todavía se está definiendo. La persistencia o no de estructuras virales durante las secuelas postCOVID así como el papel de fenómenos de autoinmunidad y de los mastocitos necesita estudios más sistematizados y multi-institucionales.
BIBLIOGRAFÍA
- Zhu N, Zhang D, Wang W, et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 2020; 382(8):727–733.
- Tse GM, To KF, Chan PK, et al. Pulmonary pathological features in coronavirus associated severe acute respiratory syndrome (SARS). J Clin Pathol. 2004; 57(3):260-265.
- Zhang H, Zhou P, Wei Y, et al. Histopathologic Changes and SARS-CoV-2 Immunostaining in the Lung of a Patient With COVID-19. Ann Intern Med. 2020; M20-0533.
- Sharon E. Fox, Aibek Akmatbekov, Jack L. Harbert et al. Pulmonary and Cardiac Pathology in Covid-19: The First Autopsy Series from New Orleans. medRxiv. 2020; 1-8.
- Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Resp Med. 2020; 8(4):420-422.
- Zhang C, Shi L, Wang FS. Liver injury in COVID-19: management and challenges. Lancet Gastroenterol Hepatol. 2020; 5(5):428-430.
- Polak SB, Van Gool IC, Cohen D, Von der Thüsen JH, Van Paassen J. A Systematic Review of Pathological Findings in COVID-19: A Pathophysiological Timeline and Possible Mechanisms of Disease Progression. Mod Pathol. 2020;1-11.
- Puelles VG, Lütgehetmann M, Lindenmeyer MT, et al. Multiorgan and Renal Tropism of SARS-CoV-2. N Engl J Med. May 13 2020. DOI: 10.1056/NEJMc. 2011400
- Frank D, Vince JE. Pyroptosis versus necroptosis: similarities, differences, and crosstalk. Cell Death Differ. 2019; 26(1): 99–114.
- Vabret N, Britton GJ, Gruber C, et al. The Sinai Immunology Review Project Immunology of COVID-19: Current State of the Science. Immunity. 2020; 52(6): 910–941
- Varga Z, Flammer AJ, Steiger P, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020; 395(10234): 1417–1418.
- Rockx B, Kuiken T, Herfst S, et al. Comparative pathogenesis of COVID-19, MERS, and SARS in a nonhuman primate model. Science. 2020; 368(6494): 1012–1015.
- Carsana L, Sonzogni A, Nasr A, et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infect Dis. 2020. https//doi.org/10.1016/5473-3099(20)30434-5
- Franks TJ, Chong PY, Chui P, et al. Lung pathology of severe acute respiratory syndrome (SARS): a study of 8 autopsy cases from Singapore. Hum Pathol. 2003; 34(8): 743-748.
- Liu J, Zheng X, Tong Q, et al. Overlapping and discrete aspects of the pathology and pathogenesis of the emerging human pathogenic coronaviruses SARS‐CoV, MERS‐CoV, and 2019‐nCoV. J Med Virol. 2020; 92(5):491–494.
- Whittaker E, Bamford A, Kenny J,et al. PIMS-TS Study Group and EUCLIDS and PERFORM Consortia Clinical Characteristics of 58 Children With a Pediatric Inflammatory Multisystem Syndrome Temporally Associated With SARS-CoV-2 . JAMA. 2020; 324(3): 259-269.
- Galván C, Català A, Carretero G, et al. Classification of the cutaneous manifestations of Covid-19: A rapid prospective nation wide consensus study in Spain with 375 cases. Br J Dermatol. 2020; 183, 71-77.
- Ackermann M, Verleden SE, Kuehnel M, et al. Pulmonary Vascular Endothelialitis,Thrombosis, and Angiogenesis in Covid-19. N Engl J Med. 2020; 383:120-128.
DECLARACIÓN DE TRANSPARENCIA
El autor/a de este artículo declara no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
ranm tv
Santiago Ramón y Cajal
Real Academia Nacional de Medicina de España
C/ Arrieta, 12 · 28013 Madrid
Tlf.: +34 91 159 47 34 | E-Mail: sramon@vhebron.net
Año 2020 · número 137 (02) · páginas 133 a 139
Enviado*: 02.06.20
Revisado: 09.06.20
Aceptado: 18.06.20
* Fecha de lectura en la RANM


