Resumen
Antecedentes: Estudios preliminares muestran que el desarrollo de la COVID-19 en pacientes con neoplasias hematológicas (NH) se asocia a una mortalidad elevada. La AMHH ha promovido una recogida prospectiva de información sobre la COVID-19 en pacientes adultos con NH con el fin de evaluar el impacto de la COVID-19 en esta población de riesgo.
Objetivos: Determinar la mortalidad por COVID-19 en pacientes con NH e identificar factores relacionados con la mortalidad por COVID-19.
Métodos: Estudio multicéntrico de registro con recogida de datos de forma prospectiva entre el 28 de febrero y el 25 de mayo de 2020, con la participación de 27 hospitales de la CM (22 públicos y 5 privados) que atienden al 90% de la población de enfermos con NH de la Comunidad de Madrid. Se incluyeron pacientes mayores de 18 años con COVID-19 sintomático y confirmado mediante RT-PCR. Para identificar los factores asociados con la mortalidad se utilizaron modelos multivariables de regresión de riesgos proporcionales (Cox).
Resultados: De los 833 pacientes notificados, finalmente se incluyeron 697 con una mediana de seguimiento de 43 días (RIC 32-53). La mediana de edad fue de 72 años (RIC 60-79), 413 (60%) pacientes eran varones y 479 (69%) y 218 (31%) tenían neoplasias linfoides y mieloides, respectivamente. La mayoría (87%) de los pacientes fueron manejados en unidades de hospitalización. En total, 230 (33%) pacientes murieron. En comparación con la población general con COVID-19, los pacientes con NH tienen tasas de mortalidad 3 veces más altas (33% frente a 10%). El análisis multivariable mostró que la edad avanzada (HR 5,20; IC del 95%: 2,12 a 12,8), el diagnóstico de leucemia mieloide aguda (2.22, 1.31-3.74), el uso reciente de quimioterapia citotóxica (1.50, 0.99-2.29) o AcMo (2.02, 1.14-3.60) y el diagnóstico de COVID-19 grave o crítico que no recibió terapia antiviral (HR 2,20; IC del 95%: 1,44-3,35) se asociaron con una peor supervivencia global.
Conclusiones: Este estudio confirma la mayor vulnerabilidad de los pacientes con NH y COVID-19. La alta mortalidad entre los pacientes con HM y los factores de riesgo descritos urge a tomar estrategias agresivas de prevención de infecciones, al menos hasta que se disponga de vacunación o tratamiento eficaces.
Abstract
Background: Preliminary studies on patients with COVID-19 and haematological malignancies (HM) show a high mortality in this population. The AMHH aimed to collect data from adult patients with HM.
Objective: The primary outcome was mortality and evaluation of potential predictive parameters of mortality.
Methods: This was a multicentre registry-based study with prospective data collection admitted to 27 Italian hospitals within the Madrid region between Feb 28 and May 25, 2020, with laboratory-confirmed and symptomatic COVID-19. This case series included consecutive patients with HM aged ≥18 years. Multivariable Cox proportional hazards model was used to identify factors associated with mortality.
Results: Of 833 patients reported, 697 were enrolled with a median follow-up of 43 days (IQR 32-53). Median age was 72 years (IQR 60–79), 413 (60%) patients were male, and 479 (69%) and 218 (31%) had lymphoid and myeloid malignancies, respectively. Most (87%) patients were managed as inpatients. Overall, 230 (33%) of 697 patients died. When compared with the general population with COVID-19, the HM patients have 3-fold higher rates of mortality (33% vs 10%). In multivariable analyses, older age (hazard ratio 5.20, 95% CI 2.12–12.8); diagnosis of acute myeloid leukaemia (2.22, 1.31–3.74), recent use of cytotoxic chemotherapy (1.50, 0.99–2.29) or MoAb (2.02, 1.14–3.60), and severe or critical COVID-19 who did not receive antiviral therapy (HR 2.20, 95% CI 1.44-3.35) were associated with worse overall survival.
Conclusion: This study adds to the evidence that patients with HM have worse outcomes than the general population with COVID-19. The high mortality among HM patients with these risk factors highlights the need for aggressive infection prevention strategies, at least until effective vaccination or treatment strategies are available.
Palabras clave: SARS-CoV-2; COVID-19; Neoplasias Hematológicas.
Keywords: Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2); COVID-19; Hematologic Neoplasms.
ÍNDICE DE ABREVIATURAS, SIGLAS Y ACRÓNIMOS
AcMo: Anticuerpos monoclonales
AMHH: Asociación Madrileña de Hematología y Hemoterapia
CM: Comunidad de Madrid
COVID-19: Enfermedad por Coronavirus 2019
NH: Neoplasias Hematológicas
RT-PCR: Reacción en cadena de la polimerasa con transcriptasa inversa
TPH: Trasplante de progenitores hematopoyéticos
UCI: Unidad de Cuidados Intensivos
INTRODUCCIÓN
La pandemia por SARS-CoV-2, causante de la enfermedad por coronavirus de 2019 (COVID-19), ha golpeado fuertemente a España, siendo la Comunidad de Madrid (población: 6.663.394; 47,8% hombres, edad media 41,8 ± 22,8 años) la más afectada con 96.947 casos confirmados y 15.271 muertes a 16 de agosto de 2020. (1)
Las neoplasias hematológicas (NH) constituyen el quinto cáncer más frecuente y la segunda causa de muerte por tumores malignos en Europa y Estados Unidos. Los pacientes con NH suelen presentar un grado alto de inmunosupresión causado por la propia enfermedad hematológica y su tratamiento. Los nuevos agentes antineoplásicos, en particular las nuevas terapias dirigidas, han mejorado la supervivencia global, pero estos agentes disminuyen la capacidad de respuesta humoral y celular del sistema inmune, lo que aumenta el riesgo y gravedad de infecciones causadas por virus.
La COVID-19 ha impactado drásticamente el manejo clínico de los pacientes con NH y receptores de Trasplante de Progenitores Hematopoyéticos (TPH). Hasta la fecha, la información disponible sobre el curso evolutivo y los factores pronósticos de la COVID-19 en esta población de pacientes es limitada. Los estudios iniciales de series de casos muestran una elevada mortalidad (37%-62%). (2-6) Sin embargo, estos estudios no están exentos de cierto sesgo al incluir sobre todo pacientes hospitalizados y con COVID-19 sintomático.
Por tanto, está plenamente justificado evaluar las características epidemiológicas, clínicas y, sobre todo, los factores que puedan predecir la evolución de la COVID-19 en estos pacientes vulnerables. La Asociación Madrileña de Hematología y Hemoterapia (AMHH) ha promovido una recogida centralizada de información sobre la infección COVID-19 en pacientes con NH. El objetivo general es evaluar el impacto de la infección en este grupo de pacientes. En particular, se pretende: i) determinar la mortalidad de COVID-19 en la población de pacientes con NH; ii) identificar factores relacionados con la mortalidad por COVID-19 que pudieran respaldar las recomendaciones para el manejo de pacientes con NH en situaciones de emergencia sanitaria como la pandemia de COVID-19.
MATERIAL Y MÉTODOS
Diseño y población de estudio
Estudio multicéntrico basado en un registro con recogida de datos de forma prospectiva de pacientes con NH diagnosticados de COVID-19 durante la primera ola de la pandemia (28 febrero a 25 de mayo de 2020). Se incluyeron todos los pacientes notificados al registro con NH mayores de 18 años y diagnóstico de COVID-19 confirmada siguiendo los criterios de la Organización Mundial de la Salud, mediante RT-PCR (reacción en cadena de la polimerasa con transcriptasa inversa).
A través de la AMHH se remitió invitación para participar en el estudio a los distintos servicios de Hematología y Hemoterapia de hospitales públicos y privados de la CM. Finalmente, participaron en el estudio 27 de los 32 hospitales, con una cobertura del 90% de la población de la CM.
Plan de trabajo y variables
Los datos se extrajeron de las historias clínicas electrónicas por los investigadores de cada centro. El registro de casos se realizó a través de una aplicación informática segura (HEMATO-MADRID COVID-19) que utiliza la herramienta REDCap, con el apoyo de la AMHH. Los datos fueron anonimizados y debidamente disociados. Posteriormente, se realizó una limpieza y verificación de los datos registrados por los investigadores del estudio. Una vez concluido el proceso de registro y verificación de los datos de los pacientes se procedió a la extracción y análisis estadístico de los mismos. El estudio recoge todas las variables clasificadas como esenciales por la OMS (Tabla 1).
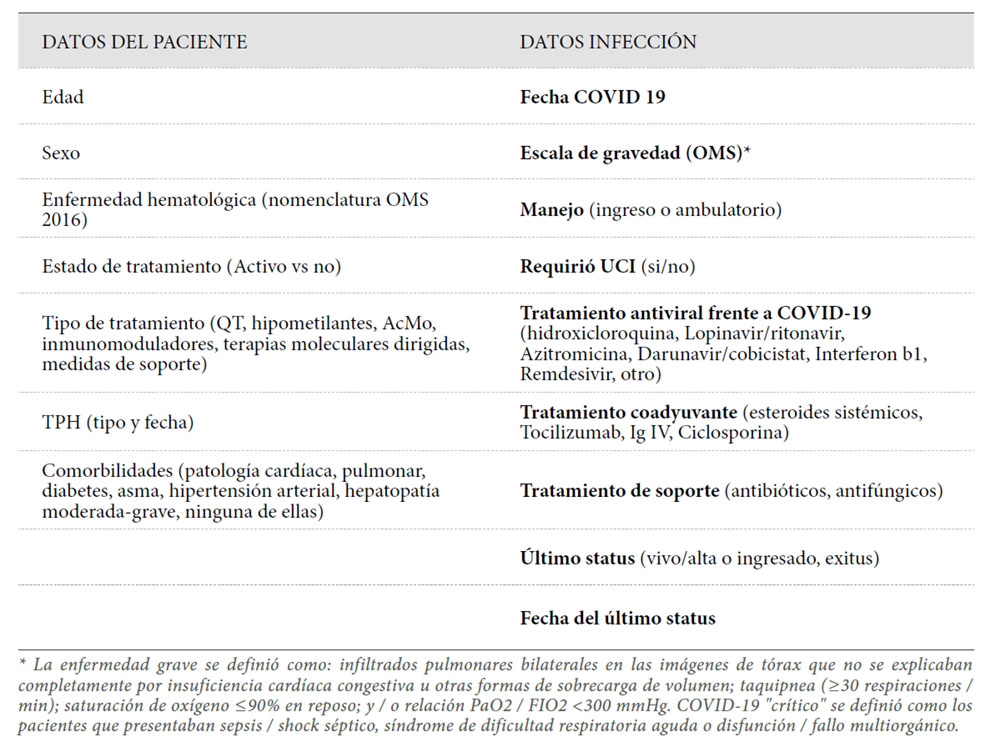
Estadística
Los objetivos principales del estudio fueron evaluar la mortalidad y los posibles factores pronósticos independientes. Las asociaciones entre la mortalidad y las terapias recibidas para COVID-19 se determinaron según la gravedad clínica (dicotomizadas como leve / moderada o grave / crítica). Los cocientes de riesgo (hazard ratio, HR) y los intervalos de confianza (IC) del 95% se estimaron con análisis de regresión de Cox. Las variables incluidas en los modelos fueron preespecificadas y restringidas en número para limitar el sobreajuste del modelo. Los análisis se generaron utilizando el software SAS / STAT, versión 9.4, SAS Institute Inc.
Consideraciones éticas
Se respetaron las normas de la declaración de Helsinki. El estudio fue aprobado por el Comité de Ética de la Investigación con medicamentos (CEIm) del Hospital Universitario 12 de Octubre (n # 20/189) y luego por el CEIm de todos los centros participantes. Se desestimó el consentimiento informado por escrito a la luz de la urgente necesidad de recopilar y notificar datos.
RESULTADOS
De una población inicial de 833 pacientes, 66 (8%) fueron excluidos por presentar enfermedades hematológicas no malignas y 70 (10%) por tratarse de COVID-19 no confirmado o no concluyente mediante RT-PCR. Finalmente, se incluyeron en el análisis 697 pacientes con NH y COVID-19 confirmado. La mediana de edad fue de 72 años (RIC 60–79), 60% fueron hombres y el 80% presentaron alguna comorbilidad, siendo hipertensión arterial (40%), cardiopatía (20%) y diabetes mellitus (17%) las más frecuentes (Tabla 2).
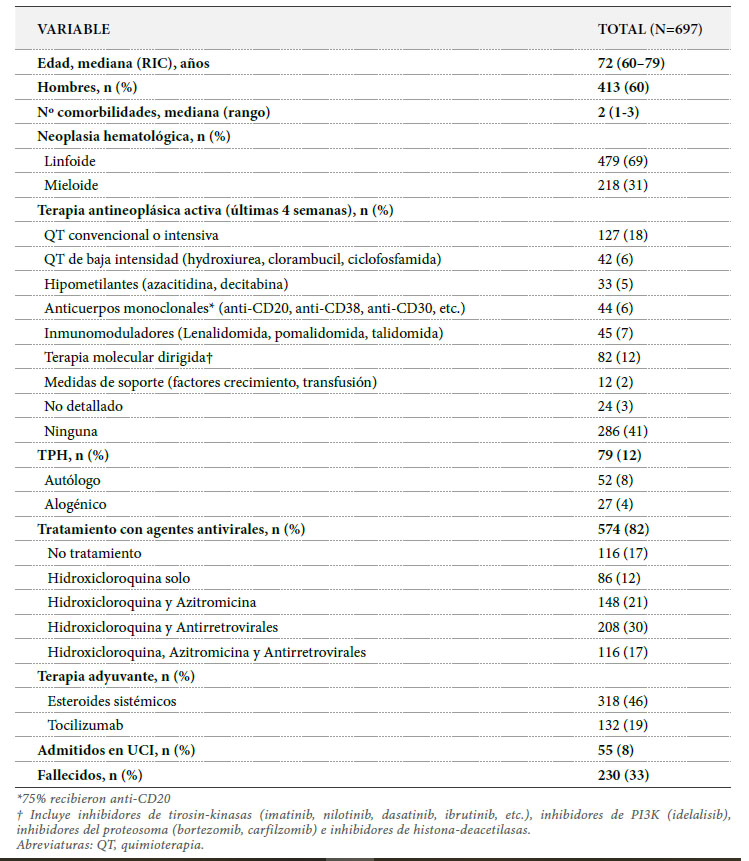
La mayoría de las NH eran de estirpe linfoide (479/69%) (en la figura 1 se detallan los tipos de NH y su frecuencia).

La COVID-19 se clasificó como grave-crítica en el 62% de los pacientes, moderada en el 23% y leve en el 15%. El 87% de los pacientes requirió hospitalización y el 13% recibió tratamiento ambulatorio. Solo 55 (8%) pacientes ingresaron en UCI. La mediana de edad de estos últimos fue de 63 años (RIC 56-70) y el 51% fallecieron.
En total fallecieron 230 (33%) pacientes con una mediana de tiempo desde la confirmación de la COVID-19 hasta el fallecimiento de 9 días (RIC 5-18). La mediana del tiempo de seguimiento de los supervivientes fue de 43 días (RIC 32-53). En la figura 1 se muestra la tasa de mortalidad según tipo de NH. La tasa de mortalidad entre los pacientes que habían recibido un TPH fue del 18%.
En total, 574 (82%) pacientes recibieron terapia antiviral, siendo la más común hidroxicloroquina en combinación con antirretrovirales, azitromicina o ambos (Tabla 2). Además, 318 (46%) y 132 (19%) pacientes recibieron corticosteroides sistémicos y tocilizumab, respectivamente.
Los factores asociados con mayor mortalidad y obtenidos mediante un modelo de regresión de Cox multivariable fueron la edad > 60 años, el diagnóstico de leucemia mieloide aguda, el tratamiento antineoplásico activo con quimioterapia convencional/intensiva o AcMo. Por otro lado, el diagnóstico de neoplasia mieloproliferativa crónica y el tratamiento activo con hipometilantes se asociaron con una reducción de la mortalidad (Tabla 3).
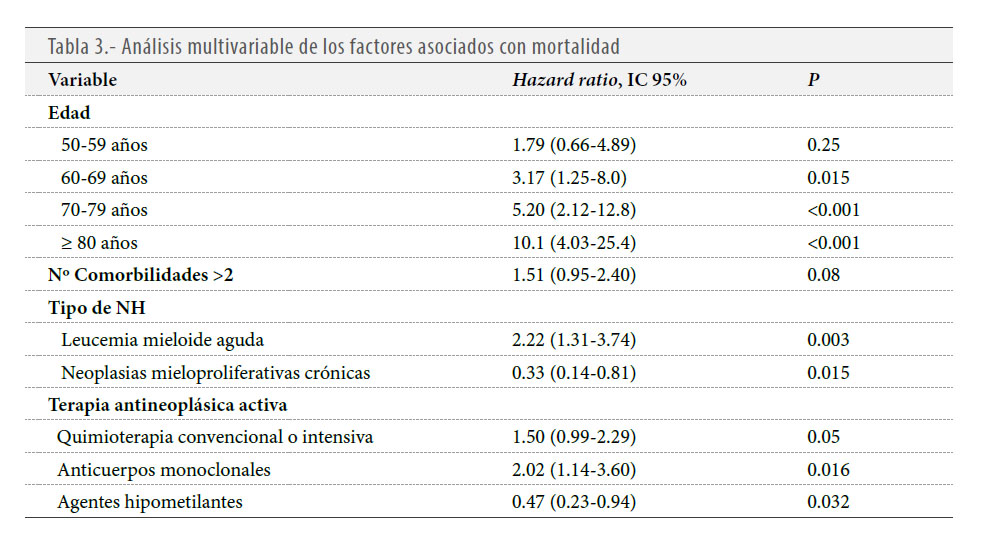
Respecto al tratamiento antiviral, los pacientes con COVID-19 grave o crítico que no recibieron terapia antiviral tuvieron un mayor mortalidad que los pacientes que recibieron cualquier combinación de antivirales (HR 2,20; IC del 95%: 1.44-3.35)
DISCUSIÓN
Nuestros hallazgos confirman que los pacientes con NH que desarrollan COVID-19 sintomático tienen 4 veces más riesgo de presentar una enfermedad grave (62% vs. 15%) y 3 veces más riesgo de muerte (33% vs. 10%) que la población general. El riesgo de muerte, también es 1.5 veces mayor que en los pacientes con tumores sólidos (13-28%).
En un análisis multivariable se confirmaron como factores independientes de mortalidad por COVID-19 la edad avanzada (en mayores de 60 años el riesgo de muerte aumentó casi 2 veces por cada década de vida), el diagnóstico de leucemia mieloide aguda y el tratamiento antineoplásico activo (últimas 4 semanas) con quimioterapia convencional-intensiva o AcMo.
En contraste a lo descrito en grandes cohortes de pacientes con tumores sólidos (7), en nuestro estudio se observó que el tratamiento antineoplásico administrado en las últimas 4 semanas puede modificar el pronóstico de la COVID-19. Los pacientes que recibieron quimioterapia citotóxica reciente o AcMo tenían un riesgo de muerte por la COVID-19 entre 1.5-2 veces mayor que los que no recibieron tratamiento antineoplásico. Estos datos son novedosos y suponen un gran impacto en el manejo de los pacientes con NH durante la pandemia.
Además, hemos constatado que el tipo de tratamiento administrado específicamente para la COVID-19 pareció afectar el riesgo de muerte. Así, los pacientes con formas graves de COVID-19 tratados con antivirales (hidroxicloroquina sola o combinada con azitromicina y antirretrovirales) tuvieron un riesgo significativamente menor (-50%) de morir en comparación con los pacientes que no recibieron antivirales. Este hallazgo debe interpretarse con precaución ya que este estudio no es aleatorizado y puede atribuirse a un sesgo por indicación del tratamiento. Es importante señalar que en más de un estudio controlado se observó que el tratamiento combinado de hidroxicloroquina y azitromicina para la COVID-19 se asoció con un aumento del riesgo de muerte.
Nuestro estudio tiene algunas limitaciones, que son inherentes al diseño, observacional de cohorte y prospectivo, cuyo fin era la acumulación rápida de pacientes durante la fase de crecimiento no lineal del brote de COVID-19 en la CM. La composición de nuestra cohorte muestra que el 87% eran pacientes hospitalizados, por lo que podría haber un sesgo a favor de casos con enfermedad más grave. Por último, este estudio no incluye otros factores de riesgo conocidos de mortalidad por COVID-19, como el tabaquismo, el estado funcional o factores sociosanitarios.
CONCLUSIONES
En conclusión, este estudio cuantifica en que medida los pacientes con NH son un grupo muy vulnerable frente a la infección por SARS-CoV-2. La elevada mortalidad por COVID19 se asocia con factores específicos como la quimioterapia citotóxica o el tratamiento con AcMo en las 4 semanas previas al diagnóstico de la COVID-19, así como el diagnóstico de leucemia mieloide aguda y el tratamiento administrado para la COVID-19. Este avance en el conocimiento puede ayudar a adecuar los recursos, actualizar las recomendaciones médicas y orientar los ensayos clínicos aleatorizados para el cuidado de los pacientes con NH durante esta pandemia global.
AGRADECIMIENTOS
Servicio de Hematología, Hospital Universitario Príncipe de Asturias, Alcalá de Henares (S Valenciano); AMHH (A Cedillo); Servicio de Hematología, Hospital Universitario Fundación Jiménez Díaz (P Llamas, J González Medina); Servicio de Hematología, Hospital Universitario Puerta de Hierro Majadahonda, (R Duarte, Lucía N Martín-Buitrago); Servicio de Hematología, Hospital Universitario La Paz (V Jiménez-Yuste, M Canales); Servicio de Hematología, Hospital Universitario Infanta Leonor (JA Hernández-Rivas, I González-Gascón); Servicio de Hematología, Hospital 12 de Octubre, (R Gil-Manso MD); Servicio de Hematología, Hospital General Universitario Gregorio Marañón (M Kwon); Servicio de Hematología, Hospital Universitario Severo Ochoa, (P Sánchez-Godoy, MC Vicente-Ayuso); Servicio de Hematología, Hospital Universitario Fundación Alcorcón, (P. Martínez-Barranco, M García Roa); Servicio de Hematología, Hospital Universitario Clínico San Carlos, (B Colás-Lahuerta, P Estival Monteliu); Servicio de Hematología, Hospital Universitario Ramón y Cajal (P Herrera, J López-Jiménez); Servicio de Hematología, Hospital Universitario de Getafe (L Benito-Parra, C Escolano Escobar); Servicio de Hematología, Hospital Universitario La Princesa (A Alegre, J Ortiz-Martín); Servicio de Hematología, Hospital Universitario Rey Juan Carlos, Móstoles (A Velasco); Servicio de Hematología, Hospital Universitario Central de la Defensa Gómez Ulla (A. Matilla); Servicio de Hematología, Hospital Universitario Moncloa (MC Aláez-Usón); Servicio de Hematología, Hospital Universitario Villalba (R Martos-Martínez); Servicio de Hematología, Hospital Universitario Quirónsalud, Pozuelo de Alarcón (C Martínez-Chamorro); Servicio de Hematología, Hospital Universitario de Móstoles (K Susana-Quiroz); Servicio de Hematología, Hospital Universitario Henares, Coslada (JF del Campo); Servicio de Hematología, MD Anderson Cancer Center Madrid (A de la Fuente); Servicio de Hematología, Hospital Universitario Infanta Sofía, San Sebastián de los Reyes (R Herráez); Servicio de Hematología, Hospital Universitario Infanta Elena, Valdemoro (A Pascual); Servicio de Hematología, Hospital Universitario Sureste, Arganda del Rey, (E Gómez); Servicio de Hematología, Hospital Universitario HM Sanchinarro (J Pérez-Oteyza); Servicio de Hematología, Hospital Universitario Tajo, Aranjuez (E Ruiz); Servicio de Hematología, Hospital Ruber (A Alonso).
BIBLIOGRAFÍA
- Comunidad de Madrid – Consejeria de Sanidad. DATOS COVID-19 COMUNIDAD DE MADRID. 2020. https://www.comunidad.madrid/sites/default/files/doc/sanidad/200817_cam_covid19.pdf (Acceso 16 agosto de 2020)
- He W, Chen L, Chen L, et al. COVID-19 in persons with haematological cancers. Leukemia 2020; 34(6): 1637-1645. Published online April 24. https://doi.org/10.1038/s41375-020-0836-7.
- Malard F, Genthon A, Brissot E, et al. COVID-19 outcomes in patients with hematologic disease. Bone Marrow Transplant 2020: https://doi:10.1038/s41409-020-0931-4.
- Shah V, Ko Ko T, Zuckerman M, et al. Poor outcome and prolonged persistence of SARS-CoV-2 RNA in COVID-19 patients with haematological malignancies; King’s College Hospital experience. Br J Haematol 2020: doi: 10.1111/bjh.16935.
- Passamonti F, Cattaneo C, Arcaini L, et al. Clinical characteristics and risk factors associated with COVID-19 severity in patients with haematological malignancies in Italy: a retrospective, multicentre, cohort study. Lancet Haematol 2020; Published: August 13, 2020: https://doi.org/10.1016/S2352-3026(20)30251-9.
- Lee LYW, Cazier JB, Starkey T, et al. COVID-19 prevalence and mortality in patients with cancer and the effect of primary tumour subtype and patient demographics: a prospective cohort study. Lancet Oncol. 2020 Aug 24. pii: S1470-2045(20)30442-3. https://doi:10.1016/S1470-2045(20)30442-3.
- Kuderer NM, Choueiri TK, Shah DP, et al. Clinical impact of COVID-19 on patients with cancer (CCC19): a cohort study. Lancet 2020; 395(10241): 1907-1918. https://doi.org/10.1016/S0140-6736(20)31187-9.
FINANCIACIÓN
Fundación Madrileña de Hematología y Hemoterapia. Este proyecto ha recibido una ayuda con una beca “Marcos Fernández-Vistare” de la Fundación Leucemia y Linfoma.
DECLARACIÓN DE TRANSPARENCIA
Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Julio García Suárez
Hematología y Hemoterapia. Hospital Universitario Príncipe de Asturias
Ctra. Alcalá-Meco s/n. Campus Universitario. Universidad de Alcalá
Alcalá de Henares · 28805 Madrid
Tlf.: +34 91 887 81 00 | E-Mail: jgarciasu.hupa@hotmail.com
Año 2020 · número 137 (02) · páginas 202 a 208
Enviado: 02.07.20
Revisado: 07.07.20
Aceptado: 14.08.20


