Resumen
La medicina de precisión tiene que basarse en 3 pilares: Un diagnóstico patológico correcto, un estadiaje preciso y unos biomarcadores que dirijan la terapia. Por tanto, para implementar una medicina de precisión correcta es fundamental optimizar el diagnóstico patológico, que pasa por la digitalización de las imágenes, que puede permitir la telepatología y la aplicación de algoritmos de patología computacional para objetivar la cuantificación de los biomarcadores en secciones tisulares.
En relación con los estudios moleculares, y dada variabilidad de lesiones moleculares existentes, es mandatorio realizar estudios de Secuenciación masiva (Next Generation Sequencing o NGS) para la búsqueda de biomarcadores que son dianas terapéuticas en gran parte de los tumores sólidos así como en sarcomas y tumores cerebrales para su diagnóstico diferencial.
Para implementar la tecnología de NGS y extenderla al mayor número posible de pacientes, es fundamental concentrar los estudios moleculares en pocos centros que puedan permitir una mayor experiencia en el manejo e interpretación de resultados por parte de los biólogos y patólogos, optimizar por tanto el coste por muestra y reducir los tiempos de respuesta desde la solicitud del estudio hasta el resultado final. En Cataluña, se ha centralizado en 5 laboratorios de anatomía patológica la realización de todos los estudios moleculares de secuenciación. Cada centro designado dispone de plataformas de NGS para dichos estudios. El circuito establecido se basa en el envío de muestras, junto con la información clínica pertinente. Los resultados obtenidos se deben integrar en el diagnóstico anatomopatológico del hospital de referencia. Semanalmente se realizan comités moleculares conjuntos con los centros de referencia. Esta concentración en red de los estudios patológicos y moleculares permite ampliar a toda la población dicho estudio molecular, independientemente de su lugar de residencia.Abstract
The precision medicine has to be based on 3 pillars: 1. In a correct pathological diagnosis. 2. In precise tumor staging.3. In the application of biomarkers associated with targeted therapy.
Therefore, for the first step to implement a correct precision medicine is mandatory to optimize the pathological diagnosis, which goes through the digitization of the images, which allow telepathology and the application of computational pathology algorithms to objectify the quantification of biomarkers in tissue sections.
In relation to molecular studies, it is mandatory to study NGS in most lung, colon and melanoma tumors, as well as sarcomas and brain tumors for their differential diagnosis.
To implement NGS technology and extend it to the largest possible number of patients, it is essential to concentrate molecular studies in a few centers that can allow more experience for biologists and pathologists, and also optimize the cost per sample. In Catalonia, by government decision, 5 pathological anatomy laboratories have been selected to carry out all the molecular sequencing studies of a community of almost 8 million inhabitants. The hospitals which depend on our Institution send us the samples and we return the molecular study in a week The results obtained must be integrated into the pathological diagnosis of the referral hospital. Joint molecular committees are held weekly with the reference centers. This network concentration of pathological and molecular studies allows this molecular study to be extended to the entire population with a similar quality, regardless of their place of residence.Palabras clave: Medicina precisión; Centros referencia; Patología digital; NGS(next generation sequencing).
Keywords: Precision medicine; Reference centers; Digital pathology; NGS(next generation sequencing).
INTRODUCCIÓN
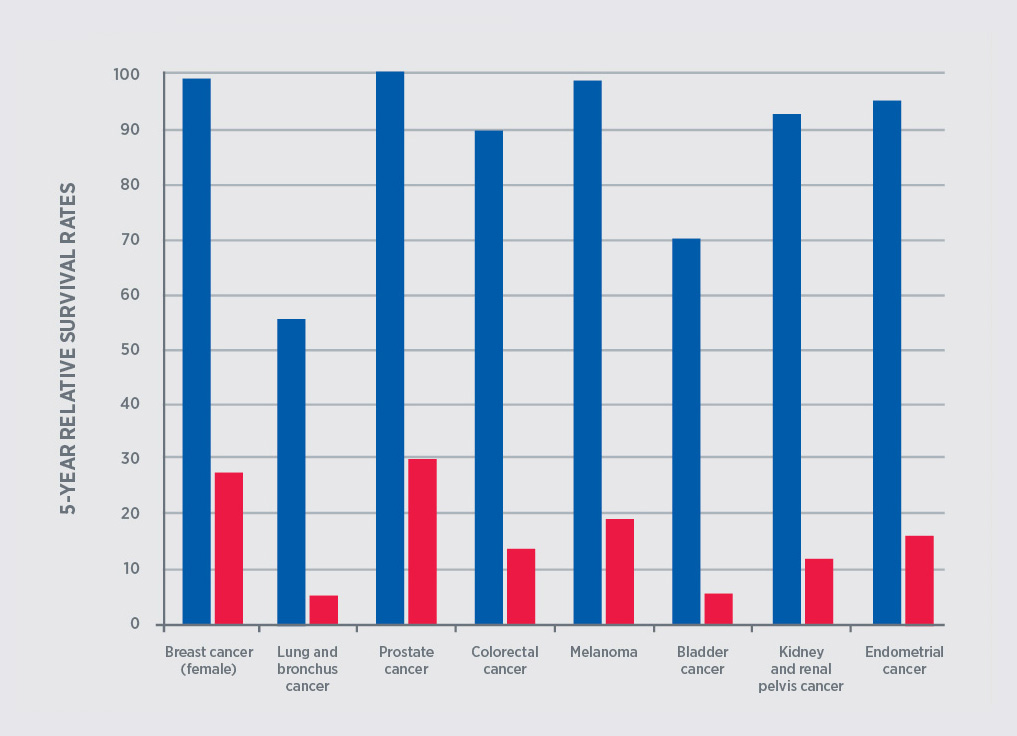
En los últimos 40 años ha habido un cambio sustancial en relación con la mortalidad atribuible a cáncer. Como se puede ver en el esquema de la gráfica adjunta, hasta mitad de los años 80 había una curva ascendente de mortalidad de tipo exponencial y que en dicha época se aplanó de forma muy significativa (1). El conocimiento molecular de los tumores era muy incipiente, que no había terapias dirigidas y que por tanto esa disminución tan relevante de la mortalidad se puede atribuir a dos factores fundamentales. En primer lugar, el que la extirpación de los tumores se realizó con criterios más objetivos, basados ya en imágenes radiológicas fundamentalmente. En segundo lugar, en que en la extirpación de las piezas se tenía muy en cuenta el estudio anatomopatológico, que incluía los márgenes de resección, así como el tipo de tumor y alteraciones del tejido normal circundante. En la actualidad, el pronóstico de la mayor parte de los tumores cuando son localizados en estadíos precoces y sin desarrollar metástasis, es muy bueno (ver gráfico adjunto), pero en la mayoría la mortalidad sigue siendo muy elevada cuando ya desarrollan metástasis, llegando a supervivencias inferiores al 5% en algunos tipos de tumores, como pueden ser los de pulmón, páncreas y de otras localizaciones.
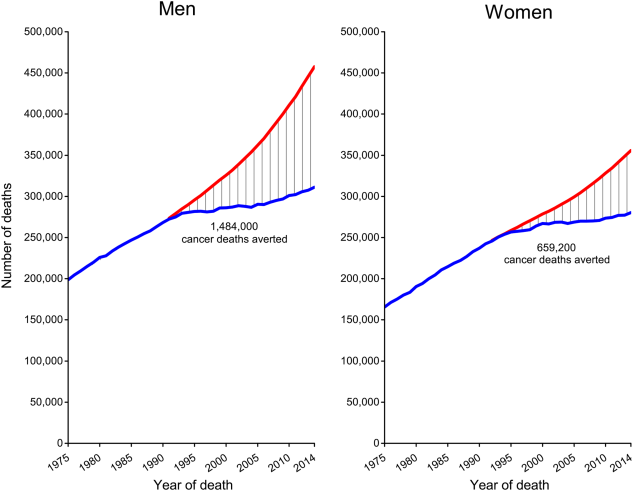
2017
Por tanto, nos tenemos que preguntar por qué sigue siendo tan malo el pronóstico de los tumores cuando hay metástasis. La respuesta es complicada, pero pensamos que puede basarse en al menos 4 premisas importantes:
- Por la gran heterogeneidad intertumoral existente (1), con cientos de tumores descritos y miles de variantes anatomopatológicas. Importante a tener en cuenta que dicha variabilidad sigue creciendo y la OMS sigue reclasificando tumores en función de alteraciones patológicas, así como de las nuevas alteraciones tumorales que se van describiendo y que pueden conferir características distintivas a determinados tipos de tumores, tanto a nivel biológico como de respuesta a terapias específicas.
- Por la gran heterogeneidad intratumoral existente en la inmensa mayoría de los tumores (2,3,4,5,6). Dicha heterogeneidad en el seno del tumor implica que no en todas las áreas va a haber las mismas alteraciones genéticas y que por tanto, los estudios moleculares que hagamos dependerán fundamentalmente de la zona biopsiada, siendo en ocasiones no representativa del conjunto del tumor. Obviamente puede entenderse que los tratamientos no serán totalmente eficaces cuando la alteración no está presente en todo el tumor, o hay otras alteraciones en otras áreas que pueden conferir resistencia.
- La presencia inevitable de pitfalls a nivel del diagnóstico y del tratamiento, en base a errores en el diagnóstico anatomopatológico, tanto por la interpretación de los patólogos como por los problemas técnicos, o por la manipulación preanalítica de la muestra. Asimismo es importante que dentro de estos pitfalls podamos interpretar y estudiar la presencia de factores de resistencia al tratamiento y que en la actualidad no son valorados en la mayor parte de las ocasiones.
- Que la Medicina de precisión molecular, basada en el estudio de múltiples alteraciones moleculares, se realiza todavía de forma muy incipiente en nuestro entorno, con gran experiencia en alteraciones únicas, pero con poca evidencia de alteraciones coexistentes.
¿EN QUÉ SE BASA LA MEDICINA DE PRECISIÓN?
Se basa en 3 pilares fundamentales, según Paweletz (7):
- En un diagnóstico anatomopatológico correcto.
- En un estadiaje preciso de los tumores.
- En la aplicación de biomarcadores asociados a la terapia dirigida.
En dichos pilares está claro el papel del patólogo, la importancia del radiólogo y del especialista en medicina nuclear para el estadiaje, así como la de los biólogos moleculares y bioinformáticos para el estudio de los biomarcadores.
¿QUÉ ES LO QUE HACEMOS HOY EN DÍA EN EL DIAGNÓSTICO?
Se hace un diagnóstico anatomopatológico clásico, basado en la interpretación subjetiva de los patrones histológicos al microscopio. Esta interpretación, al ser subjetiva, conlleva que pueda haber, y hay, discrepancias en la interpretación entre los diferentes patólogos que, según el tipo de patología, puede ser superior al 15-20% de los casos. Especialmente en tumores de partes blandas, tumores cerebrales, linfomas,….
Esta discordancia, que muy probablemente sea equiparable a la que sucede en cualquier otra de las especialidades clínicas, pensamos que se debe fundamentalmente a que la especialización de los patólogos se circunscribe generalmente al periodo de la residencia y no está suficientemente reglada la formación continuada. Esto conlleva que no haya conocimiento o familiaridad con las nuevas entidades, en un número significativo de profesionales. Asimismo, la necesidad de estudios moleculares y la precariedad de medios en algunos centros también contribuyen a esas discordancias reseñadas.
A nivel de biomarcadores, hoy en día y especialmente todo lo que se realiza a nivel tisular, el diagnóstico se basa en una interpretación subjetiva de los mismos, tanto a nivel de la expresión inmunofenotípica por inmunohistoquímica, como a nivel de las técnicas de hibridación in situ. Con esta interpretación también el nivel de discordancias es alto, y aquí es importante reseñar, no solamente la experiencia del patólogo, sino también los insuficientes controles de calidad. Por poner un ejemplo, en la Sociedad Española de Anatomía Patológica existe un excelente sistema de control de calidad con diferentes técnicas y, por ejemplo, en los controles de genes tan importantes como el HER2 para el cáncer de mama, o el ALK en cáncer de pulmón, el grado de discordancias en diferentes hospitales puede ser superior al 15%.
BIOMARCADORES, CONTEXTO TISULAR Y FACTORES DE RESISTENCIA
El estudio de los factores de resistencia asociados a terapias dirigidas, pensamos que es de extrema importancia a corto y medio plazo para optimizar los tratamientos, evitar efectos secundarios innecesarios y minimizar el coste de los tratamientos.
En el momento actual la FDA americana sólo tiene aprobados 2 tratamientos denominados agnósticos, es decir, que pueden ser aplicados a los pacientes independientemente del tipo de tumor que tengan: carcinoma, sarcoma, glioma,… Dichos marcadores son las translocaciones en los genes NTRK (NTRK 1, 2 y 3), y la presencia de inestabilidad de microsatélites fundamentalmente en carcinomas que pueden conllevar un tratamiento con inmunoterapia. El resto de los factores oncogénicos tienen que ser contextualizados en el tipo de tumor, dado que el efecto de los inhibidores dirigidos puede ser diferente y hasta contraproducente según el tipo de tumor. Por ejemplo, los inhibidores de la mutación de BRAF V600E, son eficaces en los melanomas que llevan dicha mutación. Por el contrario, tienen un efecto activador del tumor en los carcinomas de colon que llevan una mutación semejante.
En la actualidad hay nuevas alteraciones moleculares, algunas mutaciones específicas del KRAS (KRAS G12C), translocación del RET y de la neuregulina (NRG), que están en fase de validación por la FDA como eventuales marcadores también de tipo agnóstico en un futuro.
En relación con los biomarcadores y los factores de resistencia es importante ser conscientes de que, aunque haya activación de una diana terapéutica, puede haber y hay en ocasiones también factores que sabemos que pueden conllevar resistencia a la inhibición de la misma. Por ejemplo, en trabajos recientes en los que se han secuenciado más de 6.000 pacientes con tumores malignos diseminados, se han visto alteraciones accionables hasta en más del 30% de los mismos, pero el porcentaje varía mucho según el tipo de tumor. Por ejemplo, era frecuente encontrarlas en tumores uroteliales y, en cambio, se veían en menos del 65 de los tumores de páncreas y carcinomas de pulmón de células pequeñas. Lo que es muy reseñable de este trabajo es que en más del 10% se vieron varias alteraciones accionables concomitantes y especialmente que en más del 70% se detectaron mutaciones que podían conferir resistencia al tratamiento de la variante detectada. (8)
Estos son datos muy importantes a tener en cuenta y, por ejemplo, también con la inmunoterapia. Se sabe que un criterio importante para dar tratamientos con anticuerpos anti PD1 o PDL1, son los niveles de expresión de los mismos en los tumores. Pues bien, se sabe que aproximadamente el 50% de los tumores que tienen una alta expresión de PDL1 no van a responder. Por lo que conlleva efectos secundarios y de coste económico. Por ejemplo, se sabe que hay alteraciones tanto a nivel inmunológico, como en la expresión de antígenos de compatibilidad en las células tumorales que no se estudia en la actualidad, alteraciones de factores microambientales, así como múltiples alteraciones genéticas conocidas, que su presencia pueden conllevar también resistencia (9,10) (ver tabla adjunta).
- EGFR (IL6/JAK/STAT3)
- ALK
- Met exon 14
- STK11/LKB1-Mutant
- PI3K or lack PTEN
- MAP/ERK (jun)
- B catenin
- Mdm2,…
- Cytokines peIF4E and p38.
¿CÓMO PODEMOS DISMINUIR, EN EL DIAGNÓSTICO ANATOMOPATOLÓGICO, EL GRADO DE DISCORDANCIAS?
Pensamos que la única forma es concentrando la patología menos frecuente y/o con más dificultad diagnóstica (conlleva mayor subjetividad) con patólogos y/o centros de referencia diagnóstica. Especialmente tiene que estar indicado en tumores de partes blandas y hueso, neuropatología, nefropatología, patología pulmonar no tumoral, dermatología y gran parte de los tumores linfoides y hematopoyéticos.
¿CÓMO PODEMOS OPTIMIZAR, EL DIAGNÓSTICO ANATOMOPATOLÓGICO Y DISMINUIR EL GRADO DE DISCORDANCIAS Y DIAGNÓSTICOS INSUFICIENTES?
Especialmente con la PATOLOGÍA DIGITAL.
Dicha patología consiste en digitalizar/escanear todas las biopsias para su estudio posterior, integrando programas de análisis de imagen. Dicha digitalización permite su estudio en pantallas de ordenador con todas las ventajas de poder ver simultáneamente varias áreas de la tumoración, correlacionarlo con datos radiológicos macroscópicos que pueden verse también de forma paralela.
Asimismo tiene la enorme ventaja de permitir la telepatología o la interconsulta entre diversos patólogos o centros de referencia, de una forma rápida y con alta seguridad para el paciente en el sentido de que no va a haber riesgo de pérdida de bloques y material cuando se trasladan de un centro a otro. Asimismo con la patología digital se puede implementar la patología computacional, que consiste en el empleo de algoritmos que permitan la selección de aquellas células o marcadores positivos que haya en un tumor, de tal forma que se pueda posteriormente cuantificar de una forma reproducible.
Por último la aplicación de algoritmos de inteligencia artificial, que pensamos que son de una gran utilidad para el futuro y que pueden ayudar muy mucho al diagnóstico diferencial de diversas entidades. (11,12,13)
¿CÓMO SE ESTÁ IMPLEMENTANDO LA MEDICINA DE PRECISIÓN EN CATALUNYA?
En primer lugar con la digitalización de toda la red pública del Instituto Català de Salut. En esta primera parte se pretende optimizar el diagnóstico anatomopatológico, que es el primer pilar de la medicina de precisión. Este proyecto fue auspiciado por los jefes de servicio de los 7 hospitales del ICS, apoyado desde un principio por los responsables del Institut Català de la Salut. El proyecto, denominado DIGIPATICS, fue diseñado para implementar la patología digital en todos estos hospitales con la idea de favorecer la telepatología y la interconsulta entre dichos centros para poder aplicar los beneficios de la patología digital, tanto a nivel computacional como de inteligencia artificial
Es un proyecto financiado con fondos europeos. Un proyecto FEDER de optimización del proyecto anatomopatológico en red que consiguió una financiación de más de 8.400.000€. Con dicho proyecto se han instalado más de 24 escáneres, que permitirá escanear más de 1.100.000 vidrios/año, con un incremento presumible de un 10% anual. Asimismo se han instalado las diversas herramientas de soporte, plataformas de educación, servidores, equipos LAN y WAN, siendo en la actualidad probablemente la mayor red pública de patología digital del mundo.
En segundo lugar, en Catalunya, el tercer gran pilar de la medicina de precisión, que es el estudio de biomarcadores, se está realizando con la implementación de las técnicas de secuenciación masiva NGS en pacientes de todo el territorio de la Comunidad. Ha sido gracias a una pionera directriz del CATSALUT, en la que dicta que todos los estudios moleculares se agruparan en 4 grandes ámbitos (tumores sólidos, tumores hematológicos, tumores pediátricos o cáncer familiar. Dichos estudios se realizarán en centros seleccionados y en un número limitado. Cinco centros para los tumores sólidos, cinco para los hematológicos, dos para los tumores pediátricos y tres para el cáncer familiar, permitiendo de esta forma optimizar también los recursos, tanto de personal, como de tecnología y de coste por muestra. Esta directriz de empezó a implementar a partir de julio del 2021, donde ya los centros seleccionados tenían asignadas las diferentes áreas del territorio catalán para su coordinación y estudio molecular. Inicialmente se ha empezado por aquellos tumores donde hay tratamientos específicos contra dianas seleccionadas, especialmente en cáncer de pulmón, colon y melanoma. Asimismo, en dicha directriz también se va contemplar el estudio de todos aquellos tumores donde el estudio molecular en plataformas de secuenciación tipo NGS es fundamental para llegar a un diagnóstico anatomopatológico correcto. Es el caso de los sarcomas y los tumores cerebrales, donde la gran cantidad de alteraciones genéticas diferentes y entidades vinculadas a las mismas es obligatoria su realización para integrar un diagnóstico conjunto.
La directriz del CatSalut muestra de forma muy detallada la composición de cómo tiene que estar organizado el estudio de los biomarcadores, con un comité de dirección, un comité científico, un comité asesor de tumores de oncología de precisión, así como los criterios de evaluación del programa. Es importante que desde el primer momento el comité científico sean elegidas todas aquellas alteraciones genéticas que tienen que contemplarse en los estudios de NGS en los diferentes tipos de tumores y también el compromiso de revisar periódicamente dichas alteraciones e incluir todas las nuevas que se vayan describiendo e incorporando al arsenal diagnóstico y terapéutico. Asimismo el CatSalut de forma directa va a financiar dichos estudios de NGS, realizando contratos con los centros de referencia designados en los que se perfila el número de pacientes a estudiar anualmente, así como el coste por muestra.
Para la correcta implantación de la patología de precisión se deben crear comités moleculares en los servicios de anatomía patológica, intrahospitalarios en los grandes centros e interhospitalarios con revisión periódica conjunta de los casos estudiados con los patólogos y biólogos de los hospitales que remiten los casos. Siempre el estudio molecular y la muestra vuelven al hospital de origen, donde los patólogos de allí deberán integrar los resultados en su estudio anatomopatológico y sus oncólogos se encargarán del tratamiento que corresponda.
Es importante en los informes consensuar también para toda la comunidad autónoma los estudios moleculares en los que se distinguen claramente las alteraciones que se consideran accionables y dentro de éstas, las que son TIER1, es decir, aquellas que son financiadas por el sistema público, de las TIER2, que están aprobadas por la FDA o por el EMA pero todavía no hay financiación pública, y de todas aquellas que están todavía en fase de investigación clínica, especialmente en ensayos clínicos. El resto de alteraciones, sobre todo las de significado incierto, también se mencionan y se ponen en bases de datos compartidas a nivel internacional.
Por último, una reflexión sobre esta implementación de la patología digital y molecular en Catalunya, que pensamos que está marcando un hito de excelencia y sobretodo consiguiendo una equidad social muy relevante, dado que con las premisas comentadas, cualquier persona de Catalunya, independientemente de donde viva y del hospital que le toque territorialmente, va a tener acceso a un estudio molecular completo y, por tanto, a la mejor terapia posible.
Esta iniciativa contrasta con la situación en España en la actualidad, donde pensamos y esperamos que se ponga solución a corto plazo, tanto a nivel estatal como de las diversas comunidades autónomas. Hoy por hoy, en España no existe un procedimiento estandarizado ni un marco regulatorio específico para el tema de los biomarcadores en la práctica clínica. Los test de biomarcadores no están en la cartera de servicios a nivel nacional y además, la cartera de servicios que tiene un fármaco que tiene que requerir de un biomarcador, no va a acompañar necesariamente de incorporación del test de dicho biomarcador para su aplicación clínica. Por tanto, cada comunidad autónoma e incluso cada hospital, puede incorporar de forma diferente y sin exigir procesos de calidad en numerosas ocasiones.
Por último también indicar que, dada la situación, durante muchos años las compañías farmacéuticas han actuado como financiadoras de los test, lo que nos ha permitido comenzar e impulsar el estudio de los biomarcadores, pero pensamos que debería ser asumido por las administraciones públicas.
BIOGRAFÍA
- Siegel RL, Miller KD, Jemal, A. Cancer statistics, 2017. CA Cancer J Clin. 2017; 67(1): 7-30.
- Jamal-Hanjani, M, Quezada SA, Larkin J, Swanton C. Translational implications of tumor heterogeneity. Clin Cancer Res. 2015; 21(6): 1258-1266.
- Polyak, K. Heterogeneity in breast cancer. J Clin Invest. 2011; 121(10): 3786-3788. doi:10.1172/jci60534
- McGranahan N, Swanton C. Biological and therapeutic impact of intratumor heterogeneity in cancer evolution. Cancer Cell. 2015; 27(1): 15-26.
- Ramon y Cajal S, De Mattos-Arruda L, Sonenberg N, Cortes J, Peg V. The intra-tumor heterogeneity of cell signaling factors in breast cancer: p4E-BP1 and peIF4E are diffusely expressed and are real potential targets. Clin Transl Oncol. 2014; 16(11): 937-941.
- Ramon y Cajal S, Capdevila C, Hernandez-Losa J et al. Cancer as an ecomolecular disease and a neoplastic consortium. Biochim Biophys Acta Rev Cancer. 2017; 1868(2): 484-499.
- Sholl LM, Oxnard GR, Paweletz CP. Traditional diagnostics versus disruptive technology: the role of the pathologist in the era of liquid biopsy. Cancer Res. 2020; 80(16): 3197-3199.
- Flaherty KT, Gray R, Chen A et al. ; NCI-MATCH Team. The Molecular Analysis for Therapy Choice (NCI-MATCH) Trial: Lessons for genomic trial design. J Natl Cancer Inst. 2020; 112(10): 1021-1029.
- Niu M, Yi M, Li N, Luo S, Wu K. Predictive biomarkers of Anti-PD-1/PD-L1 therapy in NSCLC. Exp Hematol Oncol. 2021; 10(1):18.
- Conway JK, Kofman E, Mo SS, Elmarakeby H, Van Allen E. Genomics of response to immune checkpoint therapies for cancer: Implications for precision medicine. Genome Med. 2018; 10(1): 93.
- Schüffler PJ, Geneslaw L, Yarlagadda DVK et al. Integrated digital pathology at scale: a solution for clinical diagnostics and cancer research at a large academic medical center. J Am Med Inform Assoc. 2021; 28(9): 1874-1884.
- Yu KH, Zhang C, Berry GJ et al. Predicting non-small cell lung cancer prognosis by fully automated microscopic pathology image features. Nat Commun. 2016; 7: 12474.
- Litjens G, Sánchez CI, Timofeeva N et al. Deep learning as a tool for increased accuracy and efficiency of histopathological diagnosis. Sci Rep. 2016; 6: 26286.
DECLARACIÓN DE TRANSPARENCIA
Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
ranm tv
Santiago Ramón y Cajal
Servicio de Anatomía Patológica. Hospital Universitario Vall d’Hebron
Passeig de la Vall d’Hebron, 119 · 08035 Barcelona
E-Mail: Tlf.: +34 91 159 47 34 | E-Mail: sramon@vhebron.net
Año 2022 · número 139 (01) · páginas 9 a 15
Enviado*: 18.01.22
Revisado: 22.01.22
Aceptado: 28.01.22
* Fecha de lectura en la RANM


