Resumen
La Tomografía Computarizada (TC) estratifican a los pacientes con adenocarcinoma ductal pancreático (ACDP) en categorías según si el tumor es resecable, resecable limítrofe, o inicialmente irresecable o metastásico. En los informes de estas exploraciones los radiólogos utilizan plantillas estructuradas para garantizar que la información generada sea completa, aunque se reconoce la dificultad para identificar las infiltraciones iniciales de las estructuras adyacentes al tumor y las metástasis de pequeño tamaño. La radiómica se considera como una herramienta potencialmente útil para determinar la agresividad del tumor y construir modelos clínicos predictivos. Si estas firmas radiómicas se validan como biomarcadores pronósticos y predictivos, podrán utilizarse ayudando en la toma de decisiones para facilitar el manejo personalizado del paciente con ACDP. Los modelos con redes neuronales convolucionales proporcionan estimaciones asociadas con un perfil biológico de agresividad combinando características clínicas, semánticas y radiómicas. A pesar de los resultados esperanzadores, las principales limitaciones de la imagen cuantitativa para su uso clínico se deben a la inestabilidad de las medidas y la diversidad de imágenes obtenidas (equipos y protocolos diferentes) que dificultan la generalización de los resultados obtenidos. La disponibilidad de repositorios con imágenes normalizadas y anotadas, de diversos centros, con datos asociados (clínicos, moleculares, genéticos) y junto a la radiómica y la inteligencia artificial permitirán la predicción del comportamiento de estos tumores al momento del diagnóstico. Para su validación se necesita su validación en cohortes totalmente independientes y modelos de inferencia causal.
Abstract
Computed tomography (CT) scans stratified patients with pancreatic ductal adenocarcinoma (PDA) into categories based on whether the tumor is expected to be resectable, borderline resectable, initially unresectable, or metastatic. When reporting these exams, radiologists use structured templates to ensure that the generated information is complete, although the difficulty in identifying initial microscopic infiltrations of adjacent structures and small metastases is well recognized. Radiomics is seen as a potentially useful tool for determining tumor aggressiveness and building predictive clinical models. If extracted radiomic signatures are validated as prognostic and predictive biomarkers, they could be used aiding in decision-making to facilitate personalized patient management with ACDP. Models with convolutional neural networks provide estimations associated with a biological aggressiveness profile by combining clinical, semantic, and radiomic features. Despite encouraging results, the main limitations for clinical use of quantitative imaging are due to the instability of the measurements and the diversity of obtained images (different equipment and protocols), both making difficult to generalize the obtained results. The availability of large multicenter repositories with standardized and annotated images, and associated data (clinical, molecular, genetic), together with radiomics and artificial intelligence tools, will allow to predict the behavior of these tumors at the diagnosis. Its validation in totally independent cohorts and causal inference models is needed.
Palabras clave: Cáncer de páncreas; Radiómica; Biomarcadores de imagen; Modelos predictivos; Inteligencia Artificial.
Keywords: Pancreatic cancer; Radiomics; Image biomarkers; Predictive models; Artificial Intelligence.
INTRODUCCIÓN
El adenocarcinoma ductal pancreático (ACDP) es un cáncer con una incidencia y mortalidad ajustadas por edad en aumento constante. Entre los factores promotores se conocen la edad, el tabaquismo, el consumo de alcohol y la obesidad (1,2). Dado su curso indolente, el tumor se suele diagnosticar en estadios avanzados, siendo infrecuente su observación incidental en un examen radiológico no dirigido al páncreas o al detectar un aumento del CA.19-9 en un análisis de sangre. Este tumor es biológicamente agresivo, con una pobre vascularización, un microambiente bajo en oxígeno y nutrientes, y un marcado estroma desmoplástico (1,2). Además, estos tumores presentan una alta heterogeneidad genómica, principalmente centrada en K RAS, CDKN2A/p16, TP53 y SMAD4/PDC4 (3,4).
Los estudios de Tomografía Computarizada con contraste intravenoso (TC-C) localizan la lesión, establecen un diagnóstico diferencial, definen su forma y tamaño, la infiltración de estructuras adyacentes, y la extensión a distancia, guiando la toma de decisiones terapéuticas en las sesiones multidisciplinares. Aunque las lesiones pancreáticas pueden detectarse con ecografía, la TC-C define con mayor precisión la extensión local del tumor (invasión de planos circundantes, vasos sanguíneos y órganos) y la existencia de metástasis (vía linfática y hematológica) (5,6). La utilización de TC-C espectral mejora la detección y visibilidad de las lesiones con reconstrucciones de bajo kilovoltaje (7). La tomografía por emisión de positrones (PET/TC) suele limitarse al análisis de la recurrencia tumoral y en el seguimiento tras la terapia adyuvante. La resonancia magnética (RM) se utiliza para analizar las tumoraciones quísticas y en el preoperatorio de metástasis hepáticas con imágenes potenciadas en difusión y tras administrar un contraste hepatoespecífico. Estas metástasis síncronas están presentes hasta en un 10% de los pacientes con un estudio de TC-C negativo (5,8).
Las imágenes TC-C se obtienen en las fases arterial y venosa, definiendo al tumor, la afectación arterial y venosa circundante, los ganglios regionales y las metástasis a distancia, principalmente en hígado, peritoneo y pulmón (6). Con ello se estadifica al paciente en resecable, posiblemente resecable, localmente avanzado no resecable, o metastásico; y se define si debe tratarse con neoadyuvancia, cirugía, quimiorradiación, quimioterapia paliativa, tratamientos dirigidos o inmunoterapia (9,10). Recientemente se incluyen también fármacos inhibidores de los puntos de control inmunitario (immune check-points), y dirigidos al microambiente tumoral y su estroma desmoplástico (10,11).
Para precisar mejor el tratamiento es importante conocer la agresividad biológica y la estadificación de la enfermedad microscópica. Determinar con fiabilidad la agresividad tumoral, la microinvasión arterial y la presencia de pequeñas metástasis a distancia delimitará mejor el tratamiento inicial y su respuesta, así como el pronóstico esperado a medio y largo plazo (tiempo hasta recurrencia local, tiempo hasta metástasis a distancia, supervivencia libre de progresión, supervivencia global) (9-12).
En esta medicina de precisión se cuenta con la radiómica y el análisis genómico de las lesiones. Con la imagen cuantitativa se extraen características de los tumores para construir modelos predictivos como firmas radiómicas, o expresiones fenotípicas, con las que estimar resultados como la resecabilidad y la agresividad (13,14). Además, la inteligencia artificial (IA) genera modelos predictivos basados en datos radiómicos, genómicos y clínicos, e incluso extrae características radiómicas profundas que predicen directamente un evento clínico o el mejor tratamiento (15-17).
EXTRACCIÓN DE DATOS RADIÓMICOS COMO BIOMARCADORES DE IMAGEN
La imagen médica cuantitativa permite extraer parámetros relevantes y reproducibles de las imágenes digitales de TC-C adquiridas en los pacientes. Estas propiedades tisulares se conocen como radiómica y se extraen tras aplicar a las imágenes diferentes técnicas de procesamiento y modelos computacionales. Los descriptores numéricos extraídos pueden representar todo el tumor o una parte (parche o subregión). El análisis de hábitats o subregiones es especialmente relevante en los tumores heterogéneos (13, 17-19).
La radiómica analiza las imágenes para rastrear procesos biológicos locales que estén vinculados con comportamientos tumorales o resultados clínicos concretos (19,20). Estos biomarcadores fenotípicos de imágenes cuantifican y representan una propiedad biológica específica del tumor como indicador sustituto. Para ser clínicamente útiles, deben mejorar los resultados de las evaluaciones en uso. En la mayoría de situaciones, son los modelos multivariantes los mejores estimadores al reconocer la complejidad de la biología tumoral (13,18,21).
Veamos el flujo adecuado y necesario para la extracción de datos radiómicos y la construcción de modelos de predicción clínica.
Preparación de las imágenes
En la práctica clínica las imágenes de TC-C se obtienen con equipos, protocolos de adquisición (energía, modulación, filtros) y administraciones de contraste (medio de contraste, concentración de yodo, dosis, flujo, fases dinámicas) diferentes. Antes de que estas imágenes puedan evaluarse como “datos”, deben armonizarse (Figura 1). Esta transformación pretende eliminar estos factores de confusión para armonizar la información. En el proceso se involucran tanto métodos de dominio de características (identificación de características reproducibles, eliminar el ruido, redimensionar los vóxeles, normalizar la señal) como soluciones avanzadas de dominio de imágenes (técnicas de aumento de datos y transferencia de estilo basada en IA para la síntesis de imágenes en un marco común). Las soluciones de aprendizaje profundo han demostrado su potencial abordando la variabilidad multicéntrica mediante redes generativas adversarias GAN, técnicas de transferencia de estilo neuronal e incluso una combinación de ambas (22-24).
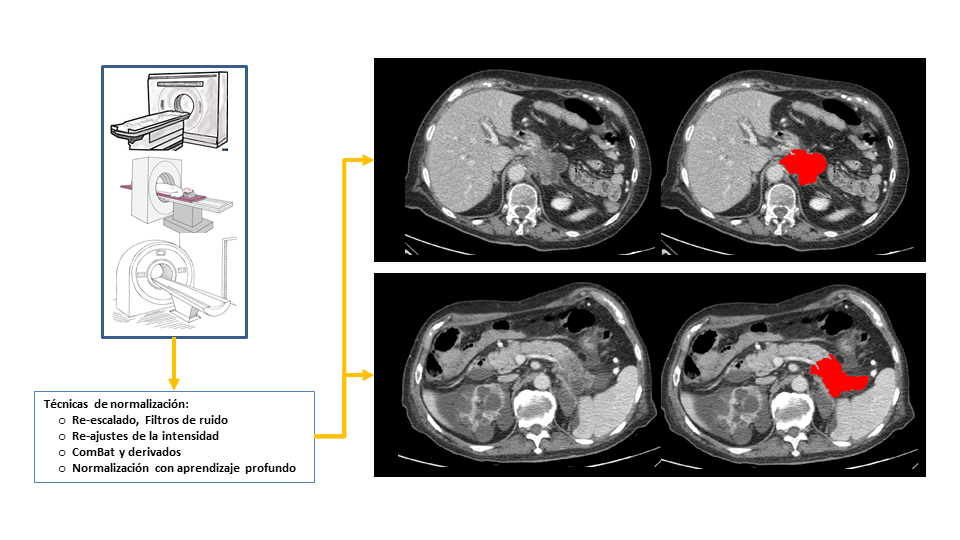
Segmentación tumoral
El tumor que se quiere analizar debe identificarse y delimitarse (Figura 1). Usualmente esta anotación se realizaba a mano en un proceso costoso. Hoy en día, la segmentación tumoral se realiza mediante redes neuronales convolucionales (CNN) como la nnU-Net basada en aprendizaje profundo (25). Esta red se configura automáticamente para cualquier tarea nueva, minimizando la variabilidad asociada a la interacción humana. Como los modelos de red entrenados sobre datos de un centro pierden calidad cuando se generalizan, se ha propuesto un método de adaptación de dominio semi-supervisado para refinar su rendimiento (26). Para la segmentación del páncreas, este cambio de dominio incluyó también al páncreas como dominio fuente y al tumor como dominio objetivo. Este método de adaptación combina el aprendizaje por transferencia y el autoaprendizaje guiado por incertidumbre, logrando una precisión muy alta con muy pocos datos para su ajuste. Esta segmentación puede extenderse a los ganglios linfáticos y las metastásicas distantes.
Características radiómicas
El análisis computacional de la imagen digital permite extraer muchos datos de la distribución de la señal (13,18). Extraer estas características radiómicas tiene el peligro del sobreajustar los modelos predictivos por la maldición de la dimensionalidad. Por ello, las variables extraídas deben limitarse a las reproducibles, relevantes y no redundantes. Para reducir esta dimensionalidad puede emplear la selección estadística o paso-a-paso de características, algoritmos de proyecciones multivariantes como el análisis de componentes principales o la factorización de matriz no negativa restringida, y las técnicas de aprendizaje (27). Las características seleccionadas deben ser robustas frente a la variabilidad entre proveedores y centros, manteniendo las características principales y armonizando sus propiedades mediante métodos como ComBat (28) (Figura 2).
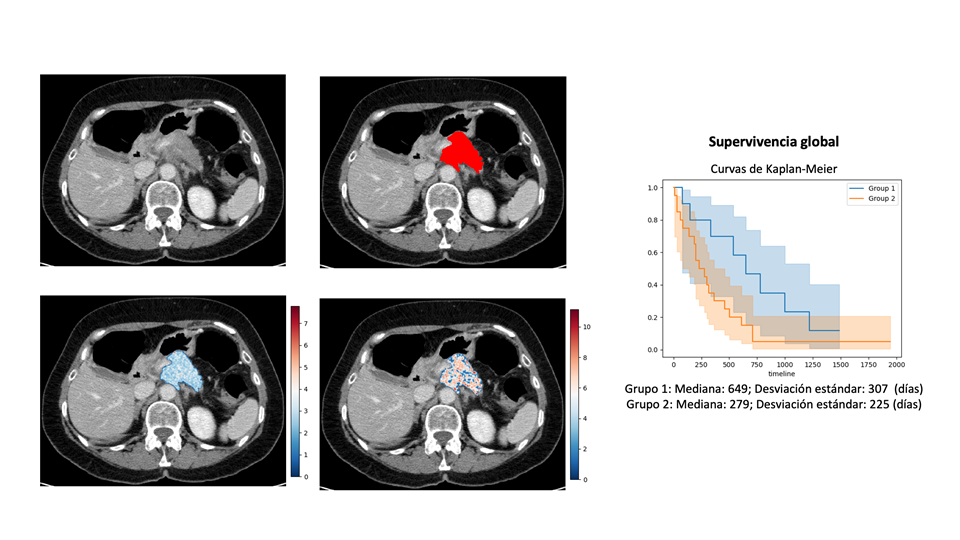
Desarrollo del modelo
La relación entre las características detectadas y los resultados esperados puede establecerse mediante diversos métodos de aprendizaje (Figura 2). La clasificación supervisada implica la identificación previa de etiquetadas asignadas a una clase esperada y la utilización de análisis estadísticos, reconocimiento de patrones o aprendizaje automático. La clasificación no-supervisada obtiene la clasificación asociativa mediante técnicas de agrupamiento (clustering) sobre conjuntos no etiquetados. También se han desarrollado recientemente variantes semi-supervisadas (27).
Los modelos radiómicos han demostrado valor pronóstico para conocer la supervivencia global en pacientes con PDAC resecable y para estratificar los pacientes resecables por el riesgo de recaída posquirúrgica (29,30). La implementación de modelos de aprendizaje por transferencia basados en CNN presentan un rendimiento que mejora significativamente el de los estudios radiómicos estándares (31). Los enfoques de Machine Learning y los análisis agnósticos de alto rendimiento han aumentado el poder predictivo de los modelos a costa de una menor comprensión biológica de su mecanismo.
Esta validación biológica es una necesidad indiscutible para la toma de decisiones clínicas (32).
Validación Biológica y Clínica
La firma radiómica se puede describir como el modelo que utiliza datos radiómicos para predecir en un tumor un evento biológico (como la hipoxia) o clínico (como la supervivencia) particular (Figura 2). Para ser reproducible y fiable, la firma debe estar validada sobre casos independientes y equilibrados, no utilizados en su construcción. Debe también enlazarse con una información patológica o correlato biológico relevante (13,19-21).
A continuación se comentan y revisan algunos candidatos radiómicos recientes.
ALGUNOS CANDIDATOS PREDICTORES
En su estadificación, un modelo de regresión logística multivariante utilizando características radiómicas de imágenes TC-C en fase venosa estimó la invasión de la vena mesentérica superior con alta precisión (AUC=0,75). Aunque no validado, el estudio empleó una serie de 181 pacientes y mejoró la predicción de resecabilidad (33). En un estudio de 194 pacientes, el análisis radiómico del espacio perivascular de la arteria mesentérica superior evidenció que un modelo con 5 características radiómicas (ángulo máximo de abrazo, diámetro máximo, distancia mínima, desviación absoluta media robusta del logaritmo, y correlación de la matriz de co-ocurrencia del nivel de gris cuadrado) presenta un rendimiento significativamente mejor en comparación con la evaluación del radiólogo (AUC=0,71 vs 0,54) (34). Si se validan, estos resultados mejorarán el rendimiento en la predicción de la resección completa R0, incluso después de la quimioterapia neoadyuvante. En otra serie de 131 pacientes con ACDP, varias características de textura se asociaron con tumores agresivos, alto grado tumoral, alto riesgo de infiltración, enfermedad ganglionar, invasión linfovascular e invasión perineural (35).
La afectación ganglionar es un predictor independientes de supervivencia. La lectura estándar de los estudios TC-C tiene una baja sensibilidad y valor predicho para detectar la afectación linfática. En una serie de 225 pacientes con ACDP, un modelo de regresión logística multivariante con 12 características radiómicas se asoció significativamente con afectación linfática, aunque sin validación externa (36). Otro estudio con 159 pacientes seleccionó 15 características radiómicas para construir un modelo combinando firma radiómica, adenopatías y grado patológico para discriminar metástasis linfáticas (AUC=0,94 en entrenamiento y 0,91 en validación interna) (37). Otro estudio con 130 pacientes mostró que una firma con 4 características radiómicas se asoció significativamente con metástasis ganglionares (AUC=0,80 en entrenamiento y 0,78 en validación) (38).
La radiómica permite también estimar el desarrollo de metástasis. Una serie de 147 pacientes mostró que la integración en un modelo de Machine Learning de un marcador bioquímico (CA.19-9), un hallazgo radiológico (necrosis) y una característica radiómica (relación superficie/volumen) se asocia significativamente con la aparición de metástasis en los 12 meses posteriores a la cirugía, pudiendo ser un indicador de quimioterapia neoadyuvante como primera línea de tratamiento (30).
Dado que el tamaño y estadio tumorales tienen una correlación imperfecta con las tasas de supervivencia a largo plazo, las predicciones pronósticas en pacientes con ACDP son inciertas. Las firmas radiómicas pueden ayudar en este contexto. Las características de textura como la hipoatenuación, homogeneidad, desviación estándar y asimetría se asociaron con una menor supervivencia general en pacientes con lesiones irresecable tratados con quimioterapia (39). Otro estudio multicéntrico con 98 pacientes como cohorte de validación demostró que una firma radiómica tiene valor pronóstico para supervivencia global (HR=1,56-1,35) (29). En otra serie de 116 pacientes, las características GLRLM (grey-level run-length matrix) de heterogeneidad se relacionaron con una peor supervivencia (40). En un estudio más amplio con 401 pacientes (151 para entrenamiento, 150 para ajuste y 100 para validación externa), la firma radiómica con un modelo support vector machine diferenció supervivencias con una precisión aceptable (AUC=0.96, 0.91 y 0.77, para cohortes de entrenamiento, ajuste y validación, respectivamente) (41).
Respecto a la radiómica profunda, las características obtenidas en 111 pacientes con redes neuronales y aprendizaje de transferencia se relacionaron con el tiempo de supervivencia, aunque sin validación (42). Los modelos Machine Learning con IA se han empleado para predecir la respuesta, progresión y supervivencia general de estos pacientes (43). Un modelo con redes neuronales basado en la arquitectura LeNet presentó un AUC de 0,74 (p<0,001) para diferenciar a los pacientes tras neoadyuvancia con respuesta patológica (grados de regresión tumoral 0-2) de aquellos sin respuesta (regresión tumoral grado 3). Cuando este modelo incorpora un 10% de disminución del CA.19–9, el rendimiento diagnóstico aumenta significativamente (AUC=0,79) (44). Si estos resultados se validaran, podría implementarse para limitar la duración de la neoadyuvancia, la necesidad de radioterapia adicional y las cirugías innecesarias. Del mismo modo, un modelo Machine Learning de predicción tras quimiorradioterapia en una serie de 50 pacientes utilizó los cambios en las características radiómicas del tumor (delta-radiómica) para crear una firma con 13 propiedades y diferenciar los respondedores (AUC=0,94 en la cohorte de validación) (45). El análisis de la sarcopenia evaluada por una red neuronal también ha mostrado una asociación significativa con la mortalidad (HR=1,58) (46).
PROPUESTA DE MANEJO DEL PACIENTE CON ACDP
Ante una tumoración pancreática, la biopsia guiada por ecografía y la TC-C son imprescindibles para guiar la mejor opción de tratamiento. Los diferentes perfiles moleculares y mutaciones permiten identificar pacientes que puedan beneficiarse de terapias médicas dirigidas. Los tumores con un comportamiento biológico altamente agresivo (como un CA.19-9 elevado) podrían beneficiarse de una quimioterapia neoadyuvante en lugar de una cirugía inicial para evitar una recurrencia temprana. Aunque todavía en uso experimental, existen soluciones de IA que permiten la segmentación de páncreas y sus tumores, así como la extracción de características radiómicas y radiómicas profundas (47). Las redes neuronales convolucionales aplicadas a las imágenes TC-C proporcionan una segmentación razonablemente precisa y una detección del cáncer con una alta sensibilidad, incluso en tumores pequeños (47). Las firmas radiómicas pueden contribuir en la definición de estos fenotipos más agresivos permitirá adaptar mejor los enfoques de quimioterapia, quimiorradiación, e inmunoterapia dirigida para mejorar la supervivencia de los pacientes (12,48). Este fenotipado pronóstico podría ayudar a clasificar la lesión (agresividad, vías moleculares), predecir la respuesta al tratamiento y el desarrollo de complicaciones. La imagen computacional también permitirá identificar los distintos hábitats y subpoblaciones tumorales para dirigir el tratamiento.
CONCLUSIONES
El ACDP presenta una baja incidencia, alta mortalidad y gran variabilidad en su expresión. Los estudios observacionales sobre datos permiten reclutar suficientes casos para evaluar si la exposición a un fenotipo radiómico determinado precisa el tratamiento en un paciente dado (47,49,50). Si se demuestran útiles, estos resultados deben validarse en ensayos clínicos (51,52). Las soluciones de IA identifican y segmentan los tumores, extrayendo información sobre la agresividad tumoral y las respuesta esperadas al tratamiento.
COLABORADORES
El artículo se ha realizado con la colaboración y las aportaciones de Leonor Cerdá-Alberich (Grupo de Investigación Biomédica en Imagen GIBI230, Instituto de Investigación Sanitaria La Fe), Alexandre Pérez-Girbés (Servicio de Radiología, Hospital Universitario y Politécnico La Fe), Roberto Díaz Beveridge (Servicio de Oncología, Hospital Universitario y Politécnico La Fe), Eva Montalvá Orón (Servicio de Cirugía, Hospital Universitario y Politécnico La Fe), Judith Pérez Rojas (Servicio de Patología, Hospital Universitario y Politécnico La Fe) y Ángel Alberich-Bayarri (Quibim SL. Valencia).
CONSENTIMIENTO DE LOS PACIENTES
No aplicable.
BIBLIOGRAFÍA
- Gupta N, Yelamanchi R. Pancreatic adenocarcinoma: A review of recent paradigms and advances in epidemiology, clinical diagnosis, and management. World Journal of Gastroenterology. 2021;27(23):3158-3181. doi:10.3748/wjg.v27.i23.3158
- Pekarek L, Fraile-Martinez O, Garcia-Montero C, et al. Towards an updated view on the clinical management of pancreatic adenocarcinoma: Current and future perspectives. Oncol Lett. 2021;22(5):809. doi:10.3892/ol.2021.13070
- Visani M, Acquaviva G, Leo AD, et al. Molecular alterations in pancreatic tumors. World Journal of Gastroenterology. 2021;27(21):2710-2726. doi:10.3748/wjg.v27.i21.2710
- Gutiérrez ML, Muñoz-Bellvís L, Orfao A. Genomic Heterogeneity of Pancreatic Ductal Adenocarcinoma and Its Clinical Impact. Cancers. 2021;13(17):4451. doi:10.3390/cancers13174451
- Vernuccio F, Messina C, Merz V, Cannella R, Midiri M. Resectable and Borderline Resectable Pancreatic Ductal Adenocarcinoma: Role of the Radiologist and Oncologist in the Era of Precision Medicine. Diagnostics. 2021;11(11):2166. doi:10.3390/diagnostics11112166
- Al-Hawary MM, Francis IR, Chari ST, et al. Pancreatic ductal adenocarcinoma radiology reporting template: consensus statement of the Society of Abdominal Radiology and the American Pancreatic Association. Gastroenterology. 2014;146(1):291-304.e1. doi:10.1053/j.gastro.2013.11.004
- Nagayama Y, Tanoue S, Inoue T, et al. Dual-layer spectral CT improves image quality of multiphasic pancreas CT in patients with pancreatic ductal adenocarcinoma. Eur Radiol. 2020;30(1):394-403. doi:10.1007/s00330-019-06337-y
- Jhaveri KS, Babaei Jandaghi A, Thipphavong S, et al. Can preoperative liver MRI with gadoxetic acid help reduce open-close laparotomies for curative intent pancreatic cancer surgery? Cancer Imaging. 2021;21(1):45. doi:10.1186/s40644-021-00416-4
- Heckler M, Hackert T. Surgery for locally advanced pancreatic ductal adenocarcinoma—is it only about the vessels? Journal of Gastrointestinal Oncology. 2021;12(5). doi:10.21037/jgo-20-313
- Schlick K, Kiem D, Greil R. Recent Advances in Pancreatic Cancer: Novel Prognostic Biomarkers and Targeted Therapy—A Review of the Literature. Biomolecules. 2021;11(10):1469. doi:10.3390/biom11101469
- Lellouche L, Palmieri L-J, Dermine S, Brezault C, Chaussade S, Coriat R. Systemic therapy in metastatic pancreatic adenocarcinoma: current practice and perspectives. Ther Adv Med Oncol. 2021;13:17588359211018540. doi:10.1177/17588359211018539
- Taboada AGM, Lominchar PL, Roman LM, et al. Advances in neoadjuvant therapy for resectable pancreatic cancer over the past two decades. Annals of Hepato-Biliary-Pancreatic Surgery. 2021;25(2):179-191. doi:10.14701/ahbps.2021.25.2.179
- Martí-Bonmatí L. La Radiómica y los Biomarcadores de Imagen. An RANM 2019;136(01):34-42. DOI: 10.32440/ar.2019.136.01.rev07
- Bartoli M, Barat M, Dohan A, et al. CT and MRI of pancreatic tumors: an update in the era of radiomics. Jpn J Radiol. 2020;38(12):1111-1124. doi:10.1007/s11604-020-01057-6
- Hayashi H, Uemura N, Matsumura K, et al. Recent advances in artificial intelligence for pancreatic ductal adenocarcinoma. World Journal of Gastroenterology. 2021;27(43):7480-7496. doi:10.3748/wjg.v27.i43.7480
- Abunahel BM, Pontre B, Kumar H, Petrov MS. Pancreas image mining: a systematic review of radiomics. Eur Radiol. 2021;31(5):3447-3467. doi:10.1007/s00330-020-07376-6
- Limkin EJ, Sun R, Dercle L, et al. Promises and challenges for the implementation of computational medical imaging (radiomics) in oncology. Ann Oncol. 2017;28(6):1191-1206. doi:10.1093/annonc/mdx034
- Larue RTHM, Defraene G, De Ruysscher D, Lambin P, van Elmpt W. Quantitative radiomics studies for tissue characterization: a review of technology and methodological procedures. Br J Radiol. 2017;90(1070):20160665. doi:10.1259/bjr.20160665
- Tomaszewski MR, Gillies RJ. The Biological Meaning of Radiomic Features. Radiology. 2021;298(3):505-516. doi:10.1148/radiol.2021202553
- Alberich-Bayarri Á, Hernández-Navarro R, Ruiz-Martínez E, García-Castro F, García-Juan D, Martí-Bonmatí L. Development of imaging biomarkers and generation of big data. Radiol Med. 2017;122(6):444-448. doi:10.1007/s11547-017-0742-x
- Shur JD, Doran SJ, Kumar S, et al. Radiomics in Oncology: A Practical Guide. RadioGraphics. 2021;41(6):1717-1732. doi:10.1148/rg.2021210037
- Mali SA, Ibrahim A, Woodruff HC, et al. Making Radiomics More Reproducible across Scanner and Imaging Protocol Variations: A Review of Harmonization Methods. J Pers Med. 2021;11(9):842. doi:10.3390/jpm11090842
- Fernández Patón M, Cerdá Alberich L, Sangüesa Nebot C, et al. MR Denoising Increases Radiomic Biomarker Precision and Reproducibility in Oncologic Imaging. J Digit Imaging. 2021;34(5):1134-1145. doi:10.1007/s10278-021-00512-8
- Fetty L, Bylund M, Kuess P, et al. Latent space manipulation for high-resolution medical image synthesis via the StyleGAN. Z Med Phys. 2020;30(4):305-314. doi:10.1016/j.zemedi.2020.05.001
- Isensee F, Jaeger PF, Kohl SAA, Petersen J, Maier-Hein KH. nnU-Net: a self-configuring method for deep learning-based biomedical image segmentation. Nat Methods. 2021;18(2):203-211. doi:10.1038/s41592-020-01008-z
- Meyer A, Mehrtash A, Rak M, et al. Domain adaptation for segmentation of critical structures for prostate cancer therapy. Sci Rep. 2021;11(1):1-14. doi:10.1038/s41598-021-90294-4
- Nanga S, Bawah AT, Acquaye BA, et al. Review of Dimension Reduction Methods. Journal of Data Analysis and Information Processing. 2021;9(3):189-231. doi:10.4236/jdaip.2021.93013
- Da-ano R, Masson I, Lucia F, et al. Performance comparison of modified ComBat for harmonization of radiomic features for multicenter studies. Sci Rep. 2020;10(1):10248. doi:10.1038/s41598-020-66110-w
- Khalvati F, Zhang Y, Baig S, et al. Prognostic Value of CT Radiomic Features in Resectable Pancreatic Ductal Adenocarcinoma. Sci Rep. 2019;9(1):5449. doi:10.1038/s41598-019-41728-7
- Palumbo D, Mori M, Prato F, et al. Prediction of Early Distant Recurrence in Upfront Resectable Pancreatic Adenocarcinoma: A Multidisciplinary, Machine Learning-Based Approach. Cancers. 2021;13(19):4938. doi:10.3390/cancers13194938
- Zhang Y, Lobo-Mueller EM, Karanicolas P, Gallinger S, Haider MA, Khalvati F. Prognostic Value of Transfer Learning Based Features in Resectable Pancreatic Ductal Adenocarcinoma. Frontiers in Artificial Intelligence. 2020;3:77. doi:10.3389/frai.2020.550890
- Tomaszewski MR, Latifi K, Boyer E, et al. Delta radiomics analysis of Magnetic Resonance guided radiotherapy imaging data can enable treatment response prediction in pancreatic cancer. Radiation Oncology. 2021;16(1):237. doi:10.1186/s13014-021-01957-5
- Bian Y, Jiang H, Ma C, et al. Performance of CT-based radiomics in diagnosis of superior mesenteric vein resection margin in patients with pancreatic head cancer. Abdom Radiol. 2020;45(3):759-773. doi:10.1007/s00261-019-02401-9
- Rigiroli F, Hoye J, Lerebours R, et al. CT Radiomic Features of Superior Mesenteric Artery Involvement in Pancreatic Ductal Adenocarcinoma: A Pilot Study. Radiology. 2021;301(3):610-622. doi:10.1148/radiol.2021210699
- Kulkarni A, Carrion-Martinez I, Jiang NN, et al. Hypovascular pancreas head adenocarcinoma: CT texture analysis for assessment of resection margin status and high-risk features. Eur Radiol. 2020;30(5):2853-2860. doi:10.1007/s00330-019-06583-0
- Bian Y, Guo S, Jiang H, et al. Relationship Between Radiomics and Risk of Lymph Node Metastasis in Pancreatic Ductal Adenocarcinoma. Pancreas. 2019;48(9):1195-1203. doi:10.1097/MPA.0000000000001404
- Li, K., Yao, Q., Xiao, J. et al. Contrast-enhanced CT radiomics for predicting lymph node metastasis in pancreatic ductal adenocarcinoma: a pilot study. Cancer Imaging 20, 12 (2020). https://doi.org/10.1186/s40644-020-0288-3
- Liang X, Cai W, Liu X, Jin M, Ruan L, Yan S. A radiomics model that predicts lymph node status in pancreatic cancer to guide clinical decision making: A retrospective study. J Cancer. 2021;12(20):6050-6057. doi:10.7150/jca.61101
- Cheng S-H, Cheng Y-J, Jin Z-Y, Xue H-D. Unresectable pancreatic ductal adenocarcinoma: Role of CT quantitative imaging biomarkers for predicting outcomes of patients treated with chemotherapy. European Journal of Radiology. 2019;113:188-197. doi:10.1016/j.ejrad.2019.02.009
- Kim HS, Kim YJ, Kim KG, Park JS. Preoperative CT texture features predict prognosis after curative resection in pancreatic cancer. Sci Rep. 2019;9(1):17389. doi:10.1038/s41598-019-53831-w
- Chang N, Cui L, Luo Y, Chang Z, Yu B, Liu Z. Development and multicenter validation of a CT-based radiomics signature for discriminating histological grades of pancreatic ductal adenocarcinoma. Quantitative Imaging in Medicine and Surgery. 2020;10(3):69202-69702. doi:10.21037/qims.2020.02.21
- Li K, Xiao J, Yang J, et al. Association of radiomic imaging features and gene expression profile as prognostic factors in pancreatic ductal adenocarcinoma. Am J Transl Res. 2019;11(7):4491-4499.
- Bakasa W, Viriri S. Pancreatic Cancer Survival Prediction: A Survey of the State-of-the-Art. Computational and Mathematical Methods in Medicine. 2021;2021:e1188414. doi:10.1155/2021/1188414
- Watson MD, Baimas-George MR, Murphy KJ, et al. Pure and hybrid Deep Learning models can predict pathologic tumor response to neoadjuvant therapy in pancreatic adenocarcinoma: A pilot study. Am Surg. 2021;87(12):1901-1909. doi:10.1177/0003134820982557
- Nasief H, Zheng C, Schott D, et al. A machine learning based delta-radiomics process for early prediction of treatment response of pancreatic cancer. NPJ Precis Oncol. 2019;3:25. doi:10.1038/s41698-019-0096-z
- Hsu T-MH, Schawkat K, Berkowitz SJ, et al. Artificial intelligence to assess body composition on routine abdominal CT scans and predict mortality in pancreatic cancer- A recipe for your local application. Eur J Radiol. 2021;142:109834. doi:10.1016/j.ejrad.2021.109834
- Barat M, Chassagnon G, Dohan A, et al. Artificial intelligence: a critical review of current applications in pancreatic imaging. Jpn J Radiol. 2021;39(6):514-523. doi:10.1007/s11604-021-01098-5
- Nappo G, Donisi G, Zerbi A. Borderline resectable pancreatic cancer: Certainties and controversies. World Journal of Gastrointestinal Surgery. 2021;13(6):516-528. doi:10.4240/wjgs.v13.i6.516
- Hernán MA, Robins JM. Using Big Data to emulate a target trial when a randomized trial is not available. Am J Epidemiol. 2016;183(8):758-764. doi:10.1093/aje/kwv254
- Suman G, Patra A, Korfiatis P, et al. Quality gaps in public pancreas imaging datasets: Implications & challenges for AI applications. Pancreatology. 2021;21(5):1001-1008. doi:10.1016/j.pan.2021.03.016
- Blomstrand H, Batra A, Cheung WY, Elander NO. Real-world evidence on first- and second-line palliative chemotherapy in advanced pancreatic cancer. World Journal of Clinical Oncology. 2021;12(9):787-799. doi:10.5306/wjco.v12.i9.787
- Martí-Bonmatí L. Estimaciones de causalidad con imagen médica en oncología. An RANM. 2021;138(01): 16–23. DOI: http://dx.doi.org/10.32440/ar.2021.138.01.rev02
DECLARACIÓN DE TRANSPARENCIA
El autor/a de este artículo declara no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
ranm tv
Luis Martí Bonmatí
Real Academia Nacional de Medicina de España
C/ Arrieta, 12 · 28013 Madrid
Tlf.: +34 91 159 47 34 | E-Mail: luis.marti@uv.es
Año 2022 · número 139 (01) · páginas 23 a 30
Enviado*: 08.02.22
Revisado: 12.02.22
Aceptado: 18.02.22
* Fecha de lectura en la RANM


