Resumen
Antecedentes y objetivos: En pacientes con hemofilia, los sangrados intraarticulares recurrentes conducen a una artropatía progresiva. La resonancia magnética (RM) es la técnica de imagen de referencia para la valoración articular. El desarrollo de protocolos ecográficos y escalas estandarizadas como “Hemophilia Early Arthropathy Detection with Ultrasound” (HEAD-US) y “Point-of-care Ultrasonography” (POC-US), permiten la monitorización de los pacientes. Nuestro objetivo principal es establecer la precisión diagnóstica de la ecografía en la detección precoz de artropatía hemofílica, con la RM como patrón de referencia. También se establecerá la variabilidad interobservador en las escalas de ecografía y RM, la asociación entre el protocolo POC-US y HEAD-US, y la capacidad de detección de la ecografía de restos hemosideróticos.
Pacientes y Métodos: Se incluyeron 45 pacientes con hemofilia. Se evalúan 180 articulaciones (rodillas y tobillos) con RM (escala Denver) y Ecografía (escala HEAD-US y POC-US).
Resultados: Existe una asociación alta y estadísticamente significativa entre las escalas ecográficas y de RM. Sólo para la variable derrame en tobillo la asociación fue media. HEAD-US obtuvo una especificidad ≥90 % en ambas articulaciones. La sensibilidad en la rodilla no superó el 82% en ningún aspecto valorado, siendo en el tobillo alta para las alteraciones del cartílago y hueso (97%) pero baja para derrames (55%). En general, los valores predictivos fueron altos, a excepción del valor predictivo negativo de derrames en rodilla y tobillo (cercanos al 70%). La ecografía no detectó restos hemosideróticos en ningún caso. Se obtuvo una concordancia estadísticamente significativa entre observadores para la valoración HEAD-US y Denver-RM. El nivel de asociación entre la escala HEAD-US y el protocolo POC-US fue medio.
Conclusiones: La ecografía es una técnica con alta precisión diagnóstica y reproducible para detectar y cuantificar los signos precoces de la artropatía hemofílica. La ecografía es insensible para detectar la hemosiderina en la hipertrofia sinovial.Abstract
Background and objectives: In hemophiliac patients, recurrent intra-articular bleeding leads to progressive arthropathy. Magnetic resonance imaging (MRI) is the gold-standard technique for joint assessment. The development of ultrasound protocols and standardized scales such as “Hemophilia Early Arthropathy Detection with Ultrasound” (HEAD-US) and “Point-of-care Ultrasonography” (POC-US) allow patient monitoring. Our main objective is to establish the diagnostic accuracy of ultrasound in the early detection of hemophilic arthropathy, with MRI as the gold standard. The interobserver variability in the ultrasound and MRI scales, the association between the POC-US and HEAD-US protocol, and the ability of ultrasound to detect haemosiderotic remnants will also be established.
Patients and Methods: 45 hemophiliac patients were included. 180 joints (knees and ankles) were evaluated with MRI (Denver scale) and Ultrasound (HEAD-US and POC-US scale).
Results: There is a high and statistically significant association between the ultrasound and MRI scales. Only for the ankle effusion variable the association was medium. The specificity of HEAD-US was ≥90% in both joints. Sensitivity in the knee did not exceed 82% in any assessed aspect, being high in the ankle for the cartilage and bone alterations (97%) but low for effusions (55%). In general, the predictive values were high, with the exception of the negative predictive value of joint leak in knee and ankle (close to 70%). Ultrasound did not detect haemosiderotic remnants in any case. Statistically significant interobserver agreement was obtained for HEAD-US and Denver-MRI assessment. The level of association between the HEAD-US scale and the POC-US protocol was medium.
Conclusions: Ultrasound is a technique with high diagnostic accuracy and reproducibility to detect and quantify the early signs of hemophilic arthropathy. Ultrasound is insensitive to detect haemosiderin in synovial hypertrophy.Palabras clave: Artropatía Hemofílica; HEAD-US; POC-US; Ecografía; Resonancia Magnética.
Keywords: Hemophilic Arthropathy; HEAD-US; POC-US; Ultrasound; Magnetic Resonance Imaging.
INTRODUCCIÓN
Las coagulopatías congénitas son enfermedades infrecuentes, dada la escasa incidencia en la población general, siendo la hemofilia la más frecuente entre ellas (1-2). Sus manifestaciones clínicas expresan la gravedad hemorrágica y se relacionan estrechamente con el nivel de factor deficitario (VIII/IX), clasificándose en: leve (nivel de factor deficitario menor de 0,4 pero >0,05 UI/ml), moderada (entre 0,05 y 0,01 UI/ml) y grave (<0,01 UI/ml) (3-7). Los sangrados intraarticulares (hemartros) suponen hasta el 85% del total de los episodios hemorrágicos en pacientes con hemofilia moderada o grave (8). La artropatía hemofílica es secundaria a hemartros recurrentes y la causa principal de morbilidad en pacientes con hemofilia grave (9). Los hemartros recurrentes, tanto clínicos como subclínicos, condicionan una hipertrofia de la sinovial, degradan el cartílago y generan lesiones óseas. Estos cambios dan lugar a una artropatía invalidante con dolor crónico y discapacidad funcional (10).
El diagnóstico y seguimiento de los hemartros es importante ya que su presentación precoz (2,5 años de media de edad), empeora el pronóstico dada la susceptibilidad al daño del cartílago inmaduro (11). La valoración periódica del estado articular permite establecer el diagnóstico de artropatía hemofílica desde los estadios precoces, instaurar y valorar las diferentes estrategias terapéuticas, y así prevenir su progresión. (12, 13-16).
Para la valoración articular se emplean diferentes modalidades de imagen. Aunque la radiografía simple ha sido la técnica más utilizada, su falta de sensibilidad ante los cambios de la membrana
sinovial y el cartílago hace que no se considere de elección en los estadios precoces ni en la valoración de la respuesta a corto plazo. Las exploraciones con resonancia magnética (RM) permiten visualizar de forma global todos los componentes de la articulación, detectando los signos precoces de la afectación articular y valorando la temporalidad del sangrado por el diferente comportamiento de señal generado por la degradación de la hemoglobina (figura 1) (17).
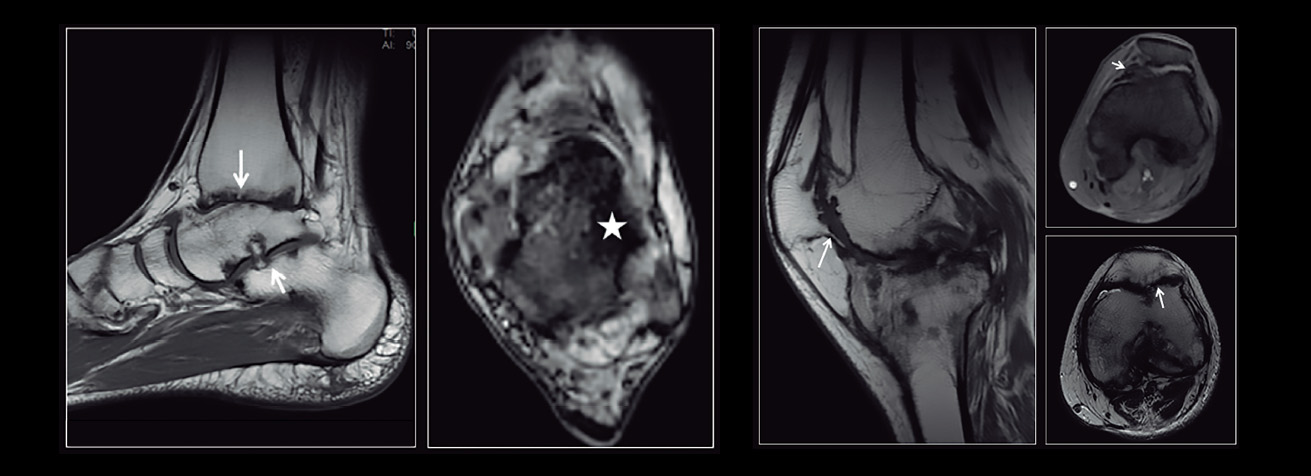
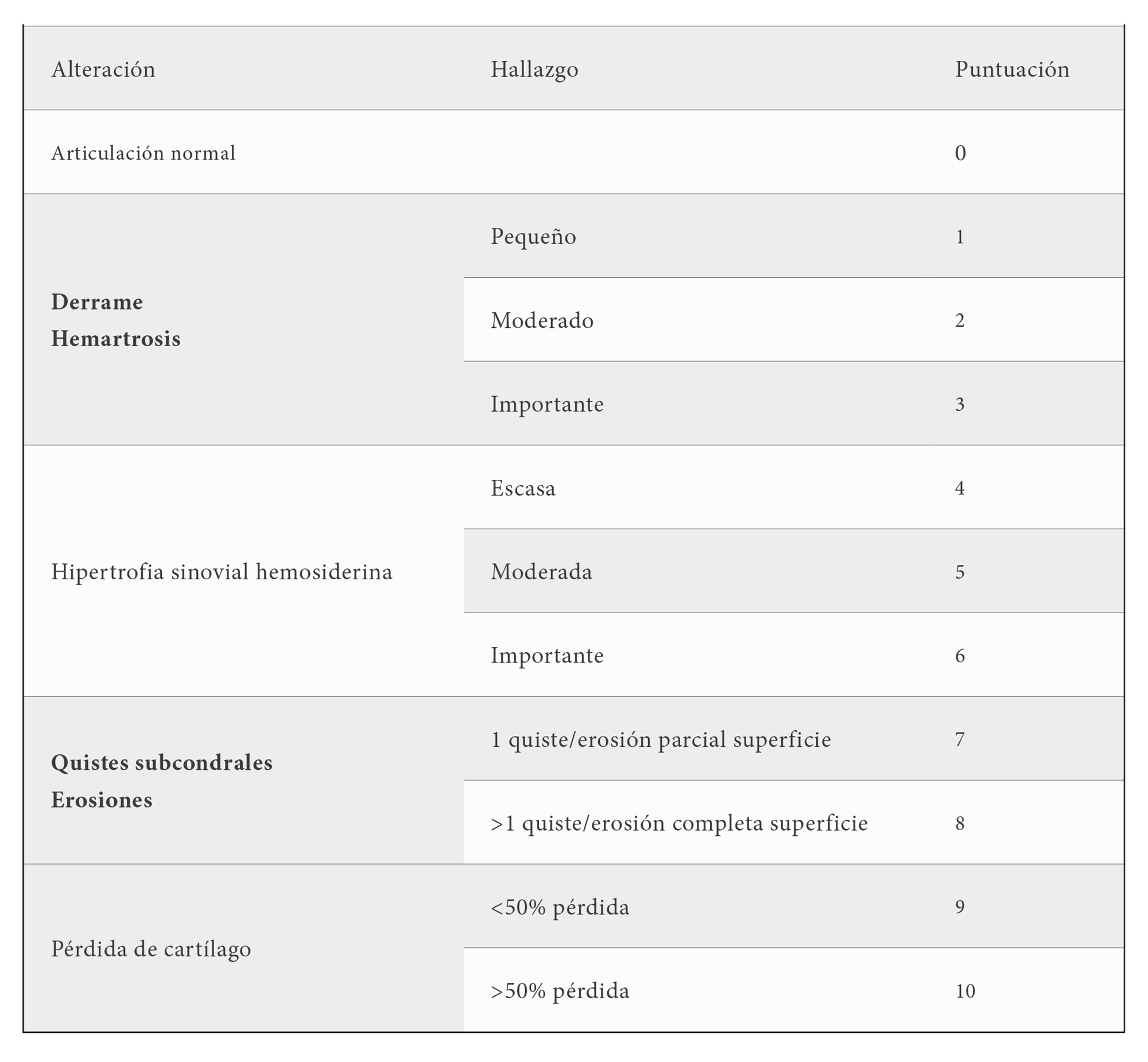
De las escalas de RM que permiten la estandarización del grado de afectación articular, la Escala de Denver es la más utilizada. En su estrategia progresiva, la puntuación final viene determinada
por el grado más grave de daño articular, con una puntuación máxima de 10 (tabla 1).
La ecografía de alta resolución con sondas lineales de alta frecuencia permite valorar la existencia de líquido intraarticular (desde 3 a 5 mL), la hipertrofia sinovial con su grado de hipervascularización inflamatoria con el uso del Doppler, y el estado del cartílago y del hueso subcondral (Figura 2) (18). Dada su amplia disponibilidad se utiliza para la valoración periódica de las articulaciones en pacientes hemofílicos. Sus inconvenientes son la falta de estandarización con dependencia de operador, la dificultad para valorar estructuras profundas y la necesidad de consensuar los criterios de evaluación y seguimiento de resultados (18-20).
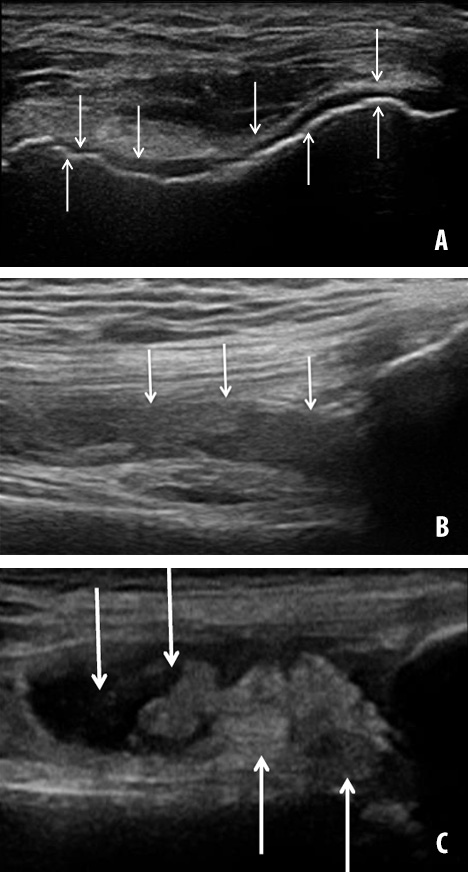
Para minimizar la falta de estandarización se creó el protocolo ecográfico estandarizado “Hemophilia Early Arthropathy Detection with Ultrasound” (HEAD-US) (tabla 2), desarrollado por Martinoli et al en 2013 (18-20). Tanto la exploración HEAD-US como su método de puntuación son fáciles y rápidos de realizar y permiten la valoración de las seis articulaciones diana habitualmente afectas: rodillas, tobillos y codos (21).

Por otro lado, también se desarrollaron protocolos ecográficos rápidos como “Point-of-care Ultrasonography” (POC-US) con el propósito de identificar la presencia o ausencia de hemartros e hipertrofia sinovial, utilizando únicamente el plano largo o sagital. Esta valoración puede realizarla cualquier facultativo (no solo radiólogos) en cualquier sitio de atención (la consulta o sala de hospitalización, por ejemplo) y no incluye medidas, siendo una valoración exclusivamente cualitativa (22-25).
Hasta el momento, son pocos los trabajos publicados que demuestren la exactitud de la ecografía comparativamente con la RM. Tampoco existen publicaciones científicas que comparen la
ecografía y RM en una población significativa de pacientes con hemofilia, ni tampoco la variabilidad interobservador de la valoración ecográfica. Además, en el caso de la correlación entre
las escalas ecográficas, no se dispone de publicaciones que permitan establecer la sensibilidad de estas para un diagnóstico exacto y el control de la respuesta al tratamiento.
Nuestro objetivo principal es determinar en pacientes con hemofilia la precisión diagnóstica de la ecografía (protocolos HEAD-US y POC-US) en la detección precoz de artropatía hemofílica,
con la RM (escala Denver) como patrón de referencia. Como objetivos secundarios se evaluará la variabilidad interobservador en el diagnóstico mediante escalas de ecografía y RM, la sensibilidad del protocolo POC-US comparativamente con la escala HEAD-US, valorando además su desempeño en el diagnóstico de la artropatía hemofílica, y la capacidad de definición tisular de la ecografía en el diagnóstico de restos hemosideróticos.
PACIENTES Y MÉTODOS
Pacientes
Se trata de un estudio prospectivo observacional aprobado por el Comité Ético de Investigación Biomédica del Hospital (IIS La Fe #2017/0612).
Se incluyeron pacientes con Hemofilia A o B en tratamiento profiláctico con concentrados de factor que acudieron a consulta de control a la Unidad de Coagulopatías en la misma semana que se realizaron las pruebas de imagen. Todos los pacientes fueron reclutados consecutivamente en un periodo de 17 meses y firmaron el consentimiento informado previamente a la realización del estudio. Se consideraron criterios de exclusión el antecedente de cirugía previa y la presencia de material de osteosíntesis o protésico en la articulación a estudio, ya que estos materiales pueden generar artefactos en las imágenes diagnosticas a evaluar.
De los 50 pacientes que cumplían los criterios de inclusión, se excluyeron 5 debido a cirugías en articulación diana en la misma semana (1 paciente), desestimar la firma del consentimiento informado (1 paciente), fallo técnico en la obtención de las imágenes de RM y rechazo de nueva cita (1 paciente) y fallo en el paso de las imágenes desde el equipo de ecografía al PACS (2 pacientes).
Finalmente, la serie se constituyó con 45 pacientes con estudios de RM y ecografía de ambas rodillas y tobillos (180 articulaciones). Se recogieron los datos clínicos y demográficos de todos los pacientes, incluyendo la edad, el tipo de hemofilia (A, B) y su grado de gravedad.
Exploraciones radiológicas
En todos los pacientes el estudio ecográfico y de RM se llevó a cabo el mismo día.
Ecografía: las exploraciones se realizaron en un equipo (Siemens ACUSON S2000) con transductor lineal de alta frecuencia (12-18 Mhz) y se llevó a cabo por un radiólogo con más de 5 años de experiencia, entrenado en los protocolos POC-US y HEAD-US (19, 26-28). El tiempo total para la obtención de las imágenes fue de aproximadamente 15 minutos. Todas las imágenes del protocolo POC-US y HEAD-US fueron evaluadas posteriormente por otro radiólogo de forma independiente y sin conocer los resultados previos, para establecer la variabilidad interobservador.
Ambos radiólogos desconocían la situación clínica del paciente y los resultados de la RM.
RM: las exploraciones se realizaron en un equipo (General Signa HDxt) de alto campo (3 Teslas). Se utilizaron bobinas de superficie específicas y se estudió cada una de las articulaciones por separado. El tiempo de máquina fue de 75 minutos aproximadamente. El protocolo de imagen incluyó en las rodillas secuencias sagital densidad protónica (DP) con supresión grasa, Turbo spin-eco potenciada en T2 (TSE-T2) y transversal gradiente T2; con FOV 20cm y grosor de corte 3,5 mm. En los tobillos, sagital DP con supresión grasa, coronal TSE-T2 y coronal gradiente T2; con FOV de 18 cm y grosor de corte 3,5 mm. Todas las imágenes se analizaron por dos radiólogos con experiencia de más de 5 años en radiología musculoesquelética, siguiendo La Escala de Denver (29), de forma independiente y sin conocer los resultados de la ecografía ni de la situación clínica del paciente.
Análisis estadístico:
Dado que la escala HEAD-US es aditiva, con una puntuación total de 8, y la escala Denver es progresiva, con una puntuación total de 10, fue necesaria una conversión de las puntuaciones explicada en la tabla 3.

Para el análisis descriptivo de la muestra se utilizó la media, la desviación estándar, el mínimo, el máximo y frecuencias. Puesto que las diferentes variables de las escalas HEAD-US y Denver son de tipo categórico, se estudió la asociación o relación entre ambas escalas utilizando las tablas de contingencia, así como los estadísticos Chi-cuadrado (χ2) y coeficiente de contingencia corregido (C). El nivel de acuerdo entre observadores se realizó mediante el estadístico Chi-cuadrado y Tau-b de Kendall (T) dado que es una medida de correlación de rango entre dos cantidades ordinales. El nivel de significancia para los test estadísticos se estableció en p<0,05.
Para interpretar los estadísticos coeficiente de contingencia corregido (C) y Tau-b de Kendall (T) se siguió la siguiente escala: 0,00 (no existe relación o asociación), 0,10 (relación muy baja), 0,25 (relación baja), 0,50 (relación media), 0,75 (relación alta), 0,90 (relación muy alta), 1,00 (relación perfecta).
Los valores diagnósticos de la escala HEAD-US se analizaron mediante la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo.
RESULTADOS
Se analizaron las 180 articulaciones, 90 rodillas y 90 tobillos, de los 45 pacientes. La media de edad de los pacientes fue de 24,1 ± 15,3 años, con un rango 4-58 años. De ellos, 60% padecía hemofilia A grave, 13% tipo A moderada, 20% tipo A leve, 5% tipo B grave y 2% tipo B moderada.
Asociación cualitativa entre las escalas HEAD-US y Denver (tabla 4):
Se obtuvo una asociación alta y estadísticamente significativa (p<0,001) entre ambas escalas en las variables derrame (C=0,83), cartílago (C=0,86), y hueso (C=0,84) en rodillas. En tobillos, se obtuvo una asociación alta en cartílago (C=0,87) y hueso (C=0,84), y una asociación moderada (C=0,59) en derrame.
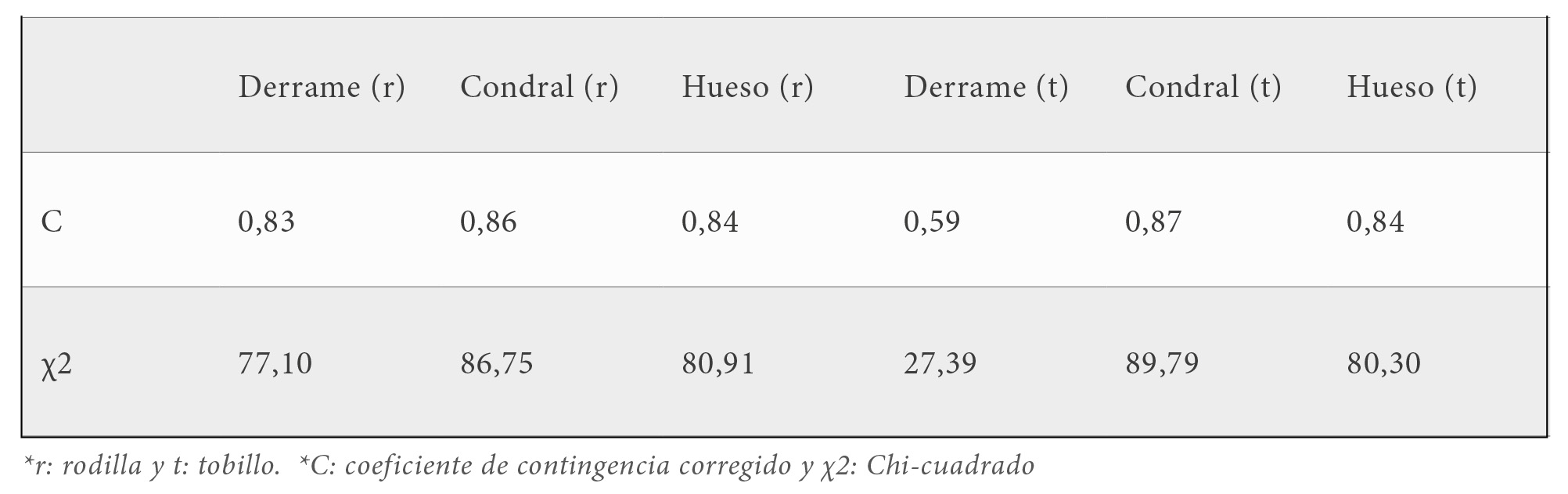
Valores diagnósticos de la escala HEAD-US
Los valores de sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo en la valoración del derrame, cartílago y hueso en rodillas y tobillos con la escala HEAD-US se muestran en las Tablas 5 y 6.
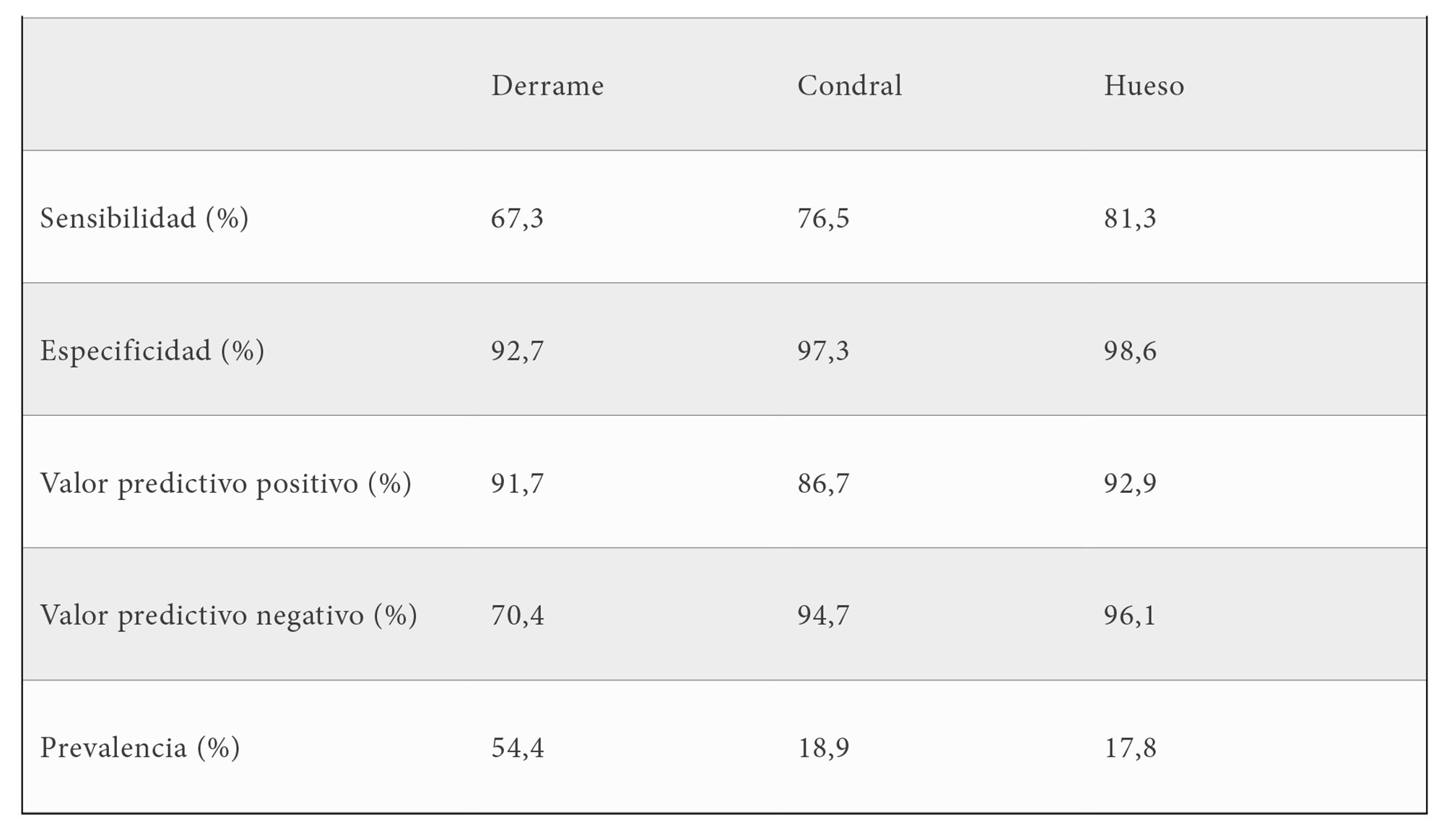

Con la escala HEAD-US se obtuvo un valor de especificidad alto en rodilla, superior al 90 %, en la detección de derrame o alteraciones en cartílago y hueso. Sin embargo, el valor de sensibilidad
fue menor, no superando el 82% en ninguno de los 3 aspectos valorados. En general, los valores predictivos fueron altos, siendo el valor predictivo negativo en derrame el valor más bajo, del 70,4 %; esto indica que el 29,6% restante serían derrames no detectados por HEAD-US. La prevalencia más alta se dio en el derrame, que se detectó en el 54,4% de las rodillas. La prevalencia de alteraciones en cartílago y hueso fue baja, menor al 20%.
La escala HEAD-US presentó valores de especificidad altos en tobillo, superior al 90%, en la detección de derrame o alteraciones en cartílago y hueso. El valor de sensibilidad fue alto en la detección de alteraciones en cartílago (97%) y hueso (97,1%), pero bajo en la detección de derrames (55%). Igual que en las rodillas, en general los valores predictivos fueron altos, siendo el valor predictivo negativo en derrame el valor más bajo (72,3%). La prevalencia en derrame en tobillos fue del 44,4%, menor que en rodillas. Sin embargo, la prevalencia de alteraciones en cartílago y hueso fue mayor en tobillos (>36 %) que en rodillas.
Análisis del nivel de acuerdo entre observadores:
Se obtuvo una asociación estadísticamente significativa entre ambos observadores tanto en la valoración con escala ecográfica HEAD-US como por Denver obtenida por RM en todos los casos. En las variables derrame, cartílago y hueso tanto en rodillas como en tobillos esta relación fue alta (Tau-b de Kendall entre 0,82 y 0,99) (Tablas 7 y 8).


Análisis de la asociación entre POC-US y HEAD-US:
El nivel de asociación entre la escala HEAD-US y el protocolo POC-US, fue media (C= 0,56 en rodillas y C=0,52 en tobillos) con p<0,001.
Detección de hemosiderina:
La hemosiderina se detectó por RM en 15 rodillas y 26 tobillos. La ecografía no detectó restos hemosideróticos en ningún caso.
DISCUSIÓN
La ecografía con el protocolo HEAD-US presenta una alta precisión diagnóstica en la valoración de la afectación sinovial, condral y ósea subcondral de la afectación articular en pacientes con artropatía hemofílica, en comparación con la RM (escala Denver) como patrón de referencia. La sensibilidad para detectar artropatía mediante HEAD-US fue de un 81,3% en las rodillas y de 97% en tobillos, con una especificidad de hasta 98% y 96% respectivamente. Los resultados mostraron una elevada correlación entre la escala ecográfica y de RM con un coeficiente de contingencia corregido de C=0,84 y estadísticamente significativo (p<0,001). El acuerdo entre ambos observadores fue excelente tanto para la valoración ecográfica como por RM, con una asociación estadísticamente significativa con una Tau-b de Kendall entre 0,82 y 0,99, validando aún más los resultados obtenidos.
La obtención de valoraciones interobservador significativamente consistentes es clínicamente muy relevante ya que permite, independientemente de quién ha realizado la escala, obtener una información reproducible del estado articular basal previo del paciente.
La variabilidad y precisión del diagnóstico de la afectación condral y del hueso subcondral de la ecografía con respecto a la RM se ha validado con resultados similares en cuanto a precisión diagnostica del protocolo HEAD-US frente a la RM como patrón de referencia (21, 30).
La baja sensibilidad de la ecografía para la detección de derrame articular en rodilla para ambos observadores puede deberse a la gran capacidad que tiene la RM para la detección de líquido sin importar su localización.
En nuestro estudio identificamos 6 articulaciones con disociación entre los hallazgos ecográficos, de RM y la clínica del paciente. En 4 de las 90 rodillas, los pacientes mostraron clínica de gonalgia persistente con negatividad en las imágenes de ecografía. El estudio de RM permitió detectar la existencia de displasia troclear, con patela alta condicionando un síndrome de hiperpresión rotuliana externa (SHRE) que justificaba el dolor femoropatelar (31). Además, en 2 de los 90 tobillos, existía clínica de dolor sin asociar hallazgos en la ecografía. El análisis de las imágenes de RM puso de manifiesto la existencia de un tejido fibroso en la región subastragalina posterior del tobillo, junto con edema óseo en región posterior de la cúpula astragalina; tras realizar anamnesis dirigida se justificó por antecedentes de entorsis recurrentes, que habían dado lugar a un síndrome de pinzamiento posterolateral del tobillo (32, 33). Por lo tanto, en casos de disociación clínico-ecográfica, con clínica persistente y ecografía negativa, es necesario valorar de forma contextualizada e individualizada la necesidad de realizar otras técnicas de imagen. En estos casos, es necesario un abordaje multidisciplinar en el que el especialista responsable del paciente (hematólogo o rehabilitador) contacte con el radiólogo para plantear la estrategia de imagen más adecuada para el paciente.
En nuestra serie, el nivel de acuerdo en la valoración de alteración de estructuras en el caso de las rodillas y tobillos fue muy significativo (p<0,001) pero el nivel de concordancia entre las escalas ecográficas se consideró como medio (Coeficiente de contingencia corregido C= 0,56 para las rodillas y Coeficiente de contingencia corregido C= 0,52 para los tobillos). Esta observación puede explicarse si tenemos en cuenta que la muestra de nuestro estudio no acudió al Servicio de Radiología por un episodio agudo, sino que se sometieron a los estudios ecográficos los días que coincidían con visitas clínicas rutinarias en la Unidad de Hemostasia y Trombosis del HUP La Fe. Sería necesario completar nuestro estudio con análisis mediante POC-US ante episodios de
hemartros agudos, en los que probablemente la correlación sería alta, debido a que los hemartros son fácilmente detectados en un solo plano ecográfico. Recordemos que POC-US obtiene información a partir de una sola imagen obtenida de forma protocolizada solo en el plano sagital, mientras que con la escala ecográfica completa (HEAD-US) son imágenes tanto en el plano sagital como transversal y no solo en la vertiente anterior y dorsal de la articulación.
En nuestra serie, la ecografía no discriminó en ningún caso si la hipertrofia sinovial tenía o no restos hemosideróticos. La valoración de restos de hemosiderina en la sinovial mediante ecografía ha
sido un tema controvertido a lo largo de la literatura. Zukotynsky et al. (34), y posteriormente Melchiorre et al. (35) afirmaron que la ecografía es un método útil para la detección de hemosiderina
en el espesor de la hipertrofia sinovial. Sin embargo, Martinoli et al. (28) y Kidder et al. (36) concluyen que no hay evidencia significativa para la establecer la capacidad de la ecografía en la detección de hemosiderina, al no demostrar diferencias entre la hipertrofia sinovial sin y con restos hemosideróticos.
En conclusión, hemos demostrado que existe una alta correlación entre la ecografía y la RM en la valoración articular de la artropatía hemofílica. En pacientes con hemofilia, la afectación sinovial, condral y ósea subcondral se observa en ecografía con una alta precisión diagnóstica, con sensibilidad, especificidad y valores predictivos altos respecto a la RM como patrón de referencia. La alta correlación interobservador para la puntuación ecográfica del derrame/sinovitis, afectación condral y del hueso subcondral valida a la ecografía como técnica reproducible en la apreciación de los signos precoces de la artropatía hemofílica. En casos de disociación clínico-ecográfica, la RM evalúa globalmente la articulación y detectó la hemosiderina en el espesor de la hipertrofia sinovial.
BIBLIOGRAFÍA
- Hoyer LW. Hemophilia A. N Engl J Med. 1994;330(1):38–47.
- Abdul-Kader Souid MD. Disorders of coagulation. En: Baren JM, Rothrock SG, Brennan JA, Brown L, editores. Pediatric Emergency Medicine. Filadelfia: Saunders-Elsevier; 2008. p. 917–926.
- Darby SC, Kan SW, Spooner RJ, et al. Mortality rates, life expectancy, and causes of death in people with hemophilia A or B in the United Kingdom who were not infected with HIV. Blood. 2007;110(3):815–825.
- Soucie JM, Nuss R, Evatt B, et al. Mortality among males with hemophilia: relations with source of medical care. The Hemophilia Surveillance System Project Investigators. Blood. 2000;96(2):437–442.
- Wang SX, Guan Y, Nie YB, et al. [Retrospectively analysis of the difference of bleeding frequency and hemophilic arthropathy between hemophilia A and hemophilia B patients]. Zhonghua Xue Ye Xue Za Zhi. 2017;38(5):404–409.
- Graveleau J, Trossaërt M, Leux C, et al. [Acquired hemophilia A. A monocentric retrospective study of 39 patients]. Rev Med Interne. 2013;34(1):4–11.
- Sachdeva A, Gunasekaran V, Ramya HN, et al. Consensus Statement of the Indian Academy of Pediatrics in Diagnosis and Management of Hemophilia. Indian Pediatr. 2018;55(7):582–590.
- Magalhães AF, de Oliveira LCO, Pitella FA, Wichert-Ana L, Engel EE, Barbieri CH. Yttrium- 90 radiosynovectomy in knees and ankles (25 joints in 22 hemophilic patients): Short-term results. Hematol Transfus Cell Ther. 2020; en prensa https://doi.org/10.1016/j.htct.2019.11.001.
- Lambert T, Auerswald G, Benson G, et al. Joint disease, the hallmark of haemophilia: What issues and challenges remain despite the development of effective therapies? Thromb Res. 2014;133(6):967–971.
- Forsyth AL, Rivard GE, Valentino A, et al. Consequences of intra-articular bleeding in haemophilia: Science to clinical practice and beyond. Haemoph. 2012;18(Suppl4):112–119.
- Hooiveld MJJ, Roosendaal G, Vianen ME, van den Berg HM, Bijlsma JWJ, Lafeber FPJG. Immature articular cartilage is more susceptible to blood-induced damage than mature articular
cartilage: An in vivo animal study. Arthritis Rheum. 2003;48(2):396–403. - Jelbert A, Vaidya S, Fotiadis N. Imaging and staging of haemophilic arthropathy. Clin Radiol. 2009;64(11):1119–1128.
- García-Massó X, Ye-Lin Y, Garcia-Casado J, Querol F, Gonzalez LM. Assessment of haemophilic arthropathy through balance analysis: A promising tool. Comput Methods Biomech Biomed Engin. 2019;22(4):418–425.
- Acharya SS. Advances in hemophilia and the role of current and emerging prophylaxis. Am J Manag Care. 2016;22(Suppl 5):s116–125.
- Forsyth AL, Zourikian N, Valentino LA, Rivard GE. The effect of cooling on coagulation and haemostasis: Should «Ice» be part of treatment of acute haemarthrosis in haemophilia? Haemoph. 2012;18(6):843–850.
- Ng WH, Chu WCW, Shing MK, et al. Role of imaging in management of hemophilic patients. AJR Am J Roentgenol. 2005;184(5):1619–1623.
- Kilkoyne RF, Nuss R. Radiological assessment of haemophilic arthropathy with emphasis on MRI findings. Haemoph. 2003;9(Suppl 1):57–63.
- Bernabeu D, Martín, C. Sonography in haemophilic joints. En: Rodríguez-Merchán EC, editor. The Haemophilic Joints: New perspectives. Londres: Wiley-Blackwell Publishers; 2003. cap. 6.
- Martinoli C, Della Casa Alberighi O, Di Minno G, et al. Development and definition of a simplifie scanning procedure and scoring method for Haemophilia Early Arthropathy Detection with Ultrasound (HEAD-US). Thromb Haemost. 2013;109(6):1170–1179.
- De la Corte-Rodriguez H, Rodriguez-Merchan EC, Alvarez-Roman MT, Martin-Salces M, Martinoli C, Jimenez-Yuste V. The value of HEAD-US system in detecting subclinical abnormalities in joints of patients in hemophilia. Expert Rev Hematol. 2018;11(3):253–261.
- Plut D, Kotnik BF, Zupan IP, et al. Diagnostic accuracy of haemophilia early arthropathy detection with ultrasound (HEAD-US): a comparative magnetic resonance imaging (MRI) study. Radiol Oncol. 2019;53(2):178-186. doi: 10.2478/raon-2019-0027. PMID: 31194690; PMCID: PMC6572497.
- Zhou JY, Rappazzo KC, Volland L, et al. Pocket handheld ultrasound for evaluation of the bleeding haemophilic joint: A novel and reliable way to recognize joint effusions. Haemoph. 2018;24(2):e77–80.
- Acharya SS, Rule B, McMillan O, Humphries TJ. Point-of-care ultrasonography (POCUS) in hemophilia A: A commentary on current status and its potential role for improving prophylaxis management in severe hemophilia A. Ther Adv Hematol. 2017;8(4):153–156.
- Mayordomo J, González-Cortés R, Bravo MC, et al. [Point-of-care ultrasound: Is it time to include it in the paediatric specialist training programme?] An Pediatr. 2003;91(3):206.e1–206.e13.
- Stoffman J, Andersson NG, Branchford B, et al. Common themes and challenges in hemophilia care: A multinational perspective. Hematol Amst Neth. 2019;24(1):39–48.
- Aznar JA, Abad-Franch L, Perez-Alenda S, Haya S, Cid AR, Querol F. Ultrasonography in the monitoring of management of haemarthrosis. Haemophilia 2011; 17(5):0. doi:10.1111/j.1365-2516.201102538.x
- Jiménez-Yuste V, Álvarez-Román MT, Martín-Salces M, et al. Joint status in Spanish haemophilia B patients assessed using the Haemophilia Early Arthropathy Detection with Ultrasound (HEAD-US) score. Haemoph. 2019;25(1):144–153.
- Martinoli C, della Casa Alberighi O, Di Minno G, et al. Development and definition of a simplifie scanning procedure and scoring method for Haemophilia Early Arthropathy Detection with Ultrasound (HEAD-US). Thromb Haemost. 2013;109(6):1170–1179.
- Lundin B, Pettersson H, Ljung R. A new magnetic resonance imaging scoring method for assessment of haemophilic arthropathy. Haemophilia. 2004; 10(4):383-389.
- Nguyen S, Lu X, Ma Y, Du J, Chang EY, von Drygalski A. Musculoskeletal ultrasound for intra-articular bleed detection: A highly sensitive imaging modality compared with conventional magnetic resonance imaging. J Thromb Haemost. 2018;16(3):490-499.
- Galland O, Walch G, Dejour H, Carret JP. An anatomical and radiological study of the femoropatellar articulation. Surg Radiol Anat. 1990;12(2):119–125.
- Kirby AB, Beall DP, Murphy MP, Ly JQ, Fish JR. Magnetic resonance imaging findings of chronic lateral ankle instability. Curr Probl Diagn Radiol. 2005;34(5):196–203.
- De Maeseneer M, Wuertzer S, de Mey J, Shahabpour M. The imaging findings of impingement syndromes of the lower limb. Clin Radiol. 2017;72(12):1014–1024.
- Zukotynsky K, Jarrin J, Babyn PS, et al. Sonography for assessment of haemophilic arthropathy in children: a systematic protocol. Haemoph. 2007;13(3):293–304.
- Melchiorre D, Linari S, Innocenti M, et al. Ultrasound detects joint damage and bleeding in haemophilic arthropathy: a proposal of a score. Haemoph. 2011;17(1):112–117.
- Kidder W, Nguyen S, Larios J, Bergstrom J, Ceponis A, von Drygalski A. Point-of-care musculoskeletal ultrasound is critical for the diagnosis of hemarthroses, inflammation and soft tissue abnormalities in adult patients with painful haemophilic arthropathy. Haemoph. 2015;21(4):530–537.
DECLARACIÓN DE TRANSPARENCIA
Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
Carlos Manuel Baracaldo Silva
Servicio de Radiología. Área Clínica de Imagen Médica.
Hospital Universitario y Politécnico La Fe de Valencia.
Avenida Fernando Abril Martonell, 106 · 46026 Valencia, España.
Año 2022 · número 139 (02) · páginas 174 a 183
Enviado: 22.04.22
Revisado: 30.04.22
Aceptado: 10.05.22


