Resumen
Introducción y Objetivos. De todas las manifestaciones clínicas que marcan el pronóstico de un paciente con Artritis Reumatoide (AR) el daño radiológico se considera una de las variables importantes. En los últimos años además de los marcadores clínicos y de laboratorio cada vez cobra un mayor interés el conocimiento de la influencia que pueden tener los factores genéticos en su capacidad predictiva en el pronóstico de la enfermedad. En esta línea estudios previos han reportado distintos resultados sobre los polimorfismos en diferentes genes asociados con el daño radiológico en esta patología. El objetivo de este estudio fue evaluar la implicación de las variables clínicas, analíticas y genéticas en el daño radiológico en una población española con Artritis Reumatoide.
Metodología. Se incluyeron 632 pacientes de la población española con Artritis Reumatoide. El genotipado de las variaciones en un solo nucleótido o SNP (Single Nucleotide Polimorphism) se llevó a cabo utilizando una micromatriz de oligonucleótidos. Se realizaron análisis de asociación de alelos y genotipos con el daño articular y una prueba de asociación de haplotipos.
Resultados. Este estudio incluye retrospectivamente 604 pacientes españoles con Artritis Reumatoide con erosiones articulares y 616 con algún tipo de cirugía debido a la enfermedad. El polimorfismo A587G (rs3741240) en el gen de la Uteroglobina se asoció con un mayor daño radiológico definido por el fenotipo RX2 (erosiones múltiples en manos y pies) y cirugía debido a la Artritis Reumatoide (OR 1.6 y 1.7 respectivamente). El polimorfismo C4599T (rs3218253) en IL2R se asoció también con el fenotipo RX2 (OR 2.95). Dentro de las variables analíticas y clínicas hemos encontrado que la duración de la enfermedad, el número de articulaciones dolorosas, la VSG, el FR y los ACPA se han asociado de manera significativa con el daño articular.
Conclusiones. Estos resultados demuestran que el polimorfismo A587G y C4599T en los genes de la Uteroglobina e IL2R respectivamente están asociados con el daño radiológico en una población española con Artritis Reumatoide.Abstract
Introduction and Objectives. Of all clinical manifestations that mark prognosis of a patient with RA, radiological damaged is considered one of the most important variables. In addition to clinical and laboratory markers are increasingly studying the influence of genetic factors in the predictive ability of the RA forecast. Previous studies have reported misleading results about polymorphisms in different genes associated with radiological damage in RA. The aim of this study was to assess the involvement of the clinical, analytical and genetic variables in the radiological damage in a Spanish RA population.
Methods. Six hundred thirty-two Spanish RA patients were included. SNP genotyping was performed using an oligonucleotide microarray. Allele and genotype association analyses with articular damage and a haplotype association test were performed.
Results. This study includes retrospectively 604 Spanish RA patients with articular erosions and 616 with surgery due to RA. The A587G polymorphism (rs3741240) in uteroglobin gene was associated with increased radiological damage defined by phenotypes RX2 (multiple erosions on hands and feet) and surgery due to RA (OR 1.6 and 1.7 respectively). IL2R polymorphism was associated with RX2 phenotype (OR 2.95). Disease duration, painful joints, ESR, RF and ACPA are the analytical and clinical variables significantly associated with articular damage.
Conclusions. These results demonstrate that the A587G and C4599T polymorphism in uteroglobin and IL2R genes respectively are associated with radiological damage in a Spanish RA population.Palabras clave: Artritis Reumatoide; Uteroglobina; IL2R.
Keywords: Rheumatoid arthritis; Uteroglobin; IL2R.
INTRODUCCIÓN
La artritis reumatoide (AR) es un trastorno inflamatorio crónico y sistémico que puede afectar a muchos tejidos y órganos donde a nivel articular el transcurso de esta enfermedad conduce a menudo a la destrucción del cartílago articular y/o a la anquilosis de las articulaciones. El objetivo terapéutico general en la AR es controlar los síntomas tales como el dolor y la inflamación articular, prevenir la pérdida funcional y retrasar o controlar la progresión del daño a nivel de las articulaciones (1).
El daño radiológico es un dato que representa el efecto acumulativo de la actividad de la enfermedad en las articulaciones y es por esta razón por lo que es importante hacer un buen seguimiento de los pacientes a pesar de que no disponemos de la información suficiente de cómo poder abordar esta búsqueda (2). El desarrollo de las erosiones articulares lleva un tiempo real, aunque en algunas ocasiones se produce mediante un proceso completamente subclínico e incluso en un tiempo muy corto, y esto es por lo que podemos explicar en algunos casos un diagnóstico no tan infrecuente como es el de una AR de inicio erosiva.
Posteriormente el curso de la enfermedad puede variar también de manera considerable de un paciente a otro (tanto en términos de nivel de gravedad de daño radiológico como de rapidez del desenlace).
Esto significa que para poder seleccionar a los candidatos adecuados e implementar terapias más agresivas en una etapa temprana de la patología sería de importante ayuda disponer de predictores de marcadores radiográficos de progresión (3). Actualmente en la práctica clínica existen ciertos marcadores que nos pueden orientar para tomar decisiones terapéuticas, pero todavía en este momento los resultados son pobres en esta área. Hasta el momento los factores pronósticos eficientes que nos permiten predecir el desenlace en la AR se basan principalmente en la correlación entre las variables clínicas y los desenlaces (4).
Marcadores clínicos como los autoanticuerpos y los reactantes de fase aguda son útiles para definir el pronóstico en las primeras etapas de la AR; no obstante para conocer el curso de la enfermedad y su pronóstico a largo plazo lo ideal es que los marcadores no varíen y en este sentido reseñamos la importancia y en general la mayor fiabilidad que pueden aportar los factores genéticos. Además de estos últimos debemos tener en consideración a los SNPs (single nucleotide polimorphism) los cuales son fácilmente evaluables en estudios poblacionales ya que suelen ser abundantes a nivel del genoma y relativamente fáciles de detectar en su estudio. Las variaciones en un solo nucleótido o SNP son las que condicionan que cada individuo sea diferente a otro respecto a la susceptibilidad a padecer distintas enfermedades, al pronóstico de la enfermedad y a la respuesta a fármacos entre otros.
En la revisión de la literatura encontramos que ciertos genes tales como son el HLA-DRB1, la estromelisina, PTPN22, TNF-α, IL-1, IL-6, IL-10, IL-4 y la IL-13 ya se han asociado previamente en algunos estudios con el daño articular (5, 6, 7, 8). Además se ha constatado la relevancia que tiene el epítopo compartido y en particular el gen HLA-DRB1*0401 dado que está asociado en general con una mayor agresividad de esta patología y con el desarrollo de erosiones. De igual forma en otro trabajo se observó que aquellos pacientes con el polimorfismo 1858T en el gen PTPN22 tenían una puntuación Larsen más alta y con un mayor daño articular en consecuencia (9). Cantagrel y colaboradores también demostraron en un estudio realizado en AR con dos años de seguimiento en 108 pacientes, que el SNP IL1B 3954T (rs1143634) aumentaba el riesgo de desarrollar erosiones y esto similar a lo hallado en otro estudio pero en el polimorfismo IL1B-511 (rs16944).
La capacidad de un SNP simple para predecir el riesgo de la AR y su agresividad suele ser bastante pequeña, pero puede aumentar significativamente con la combinación de múltiples SNP y parámetros clínicos y/o analíticos. La tecnología de la que ahora disponemos para evaluar el ADN es capaz de llegar a detectar múltiples SNPs en un solo estudio y esto nos va a permitir de una manera sencilla y rentable obtener diferentes modelos predictivos. En los últimos años el avance en esta línea fue enorme y esto permitió mejorar el conocimiento en la susceptibilidad genética en la AR. Además como ya he mencionado con anterioridad, en esta patología un apartado relevante es el conocimiento de la agresividad y severidad de la misma (en términos de daño estructural, de desarrollo de erosiones óseas y prótesis articulares o cirugía).
En base a esto lo que hemos intentado es realizar un estudio que nos aporte suficiente información (polimorfismos genéticos, variables clínicas y de laboratorio) al inicio de la enfermedad acerca de la evolución radiográfica de la AR.
MATERIAL Y MÉTODOS
Población de estudio
Entre mayo del 2006 y enero del 2008 se realizó una revisión exhaustiva de manera retrospectiva de las historias clínicas de pacientes con Artritis Reumatoide (Anexo 1-Cuaderno de Recogida de Datos) incluyendo una cohorte final de 632 pacientes españoles que cumplían los criterios de clasificación ACR de 1987 (en ese momento no disponíamos todavía de los actualizados criterios de clasificación del 2010). Todos los pacientes fueron seguidos en las Unidades de Reumatología de seis hospitales nacionales que enumero a continuación: Complejo Hospitalario Universitario A Coruña (A Coruña), Hospital Universitario La Paz (Madrid), Hospital Vírgen de las Nieves (Granada), Hospital Universitario Puerta de Hierro (Madrid), Hospital Clinic (Barcelona) y Hospital Reina Sofía (Córdoba).
Los criterios de inclusión establecidos para los participantes fueron los siguientes:
- Pacientes con Artritis Reumatoide que cumplan los criterios ACR de 1987.
- Edad de debut de la Artritis Reumatoide por encima de los 18 años.
- Raza caucásica.
- Artritis Reumatoide con más de 5 años de evolución.
- Artritis Reumatoide diagnosticada después del 1 de enero de 1990 (este punto fue añadido para así garantizar el acceso al tratamiento con Metotrexato [el cual fue establecido como el fármaco antirreumático modificador de la enfermedad-FAME de primera línea]).
604 de 632 pacientes con AR reclutados y 616 de los 632 pacientes con AR tenían al análisis daño articular definido por erosiones y cirugía respectivamente. Definimos dos fenotipos de daño articular identificados como RX2 (erosiones múltiples en manos y pies) y cirugía (sinovectomía, artroplastia y/o reemplazo total de la articulación).
Este estudio fue aprobado por el Comité Ético del Hospital Universitario Puerta de Hierro (Madrid, España) y de acuerdo con la Declaración de Helsinki. Todos los pacientes dieron su consentimiento informado por escrito.
Indicadores de pronóstico clínico
Las características iniciales de los pacientes se recopilaron de manera retrospectiva mediante la revisión de los registros de su primera visita realizada en la consulta de Reumatología. La Velocidad de Sedimentación Globular (VSG) se determinó por el método de Westergren, la Proteína C Reactiva (PCR) y el Factor Reumatoide (FR) por nefelometría y los Anticuerpos Anti-Péptido Cíclico Citrulinado (IgG-ACPA) de clase IgG por ELISA. En menos del 10% de los pacientes para los que no se disponía de niveles de anticuerpos ACPA se realizaron las mediciones específicas para el estudio en el momento de la recopilación de datos.
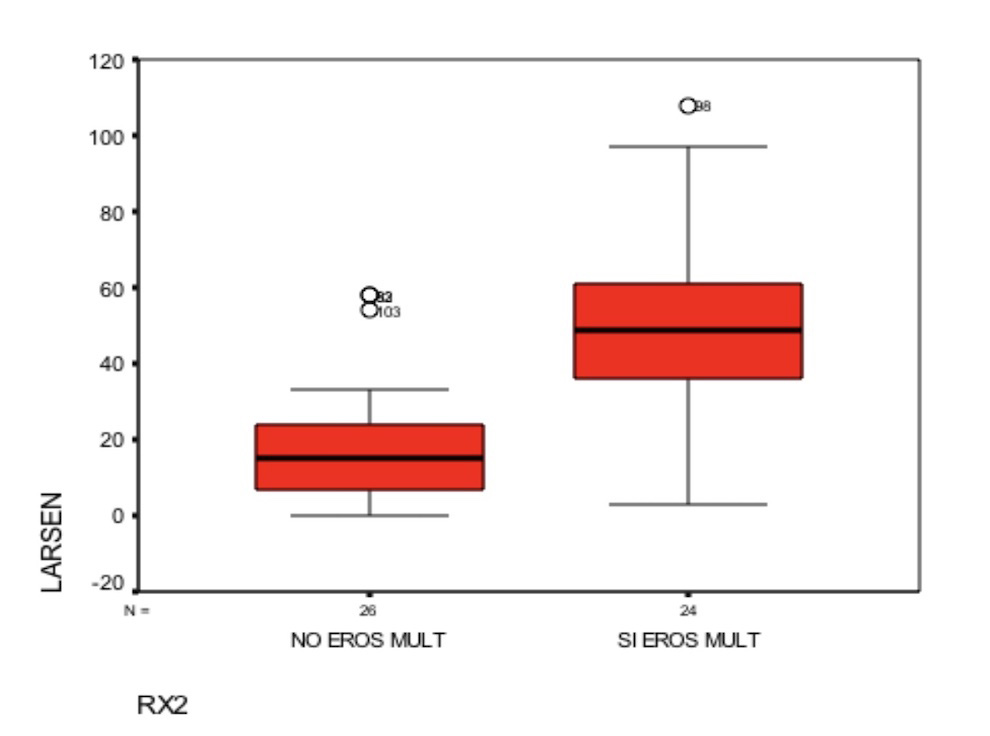
Asimismo se realizaron radiografías de manos y pies en el momento de la extracción de ADN y se cuantificaron las erosiones. Para comprobar la asociación entre nuestro método de puntuación semicuantitativa y la puntuación de Larsen se seleccionó aleatoriamente una submuestra representativa de los casos. La media de la puntuación de Larsen en el grupo de pacientes altamente erosivos fue significativamente superior al resto de pacientes [49.4 (D.E. 25.4) vs 18.5 (D.E. 16.6); p<0.0001) (Figura 1) y el análisis de regresión mostró una relación positiva entre el número de erosiones y la puntuación de Larsen (p<0.0001).
Genotipado de SNPs de daño articular
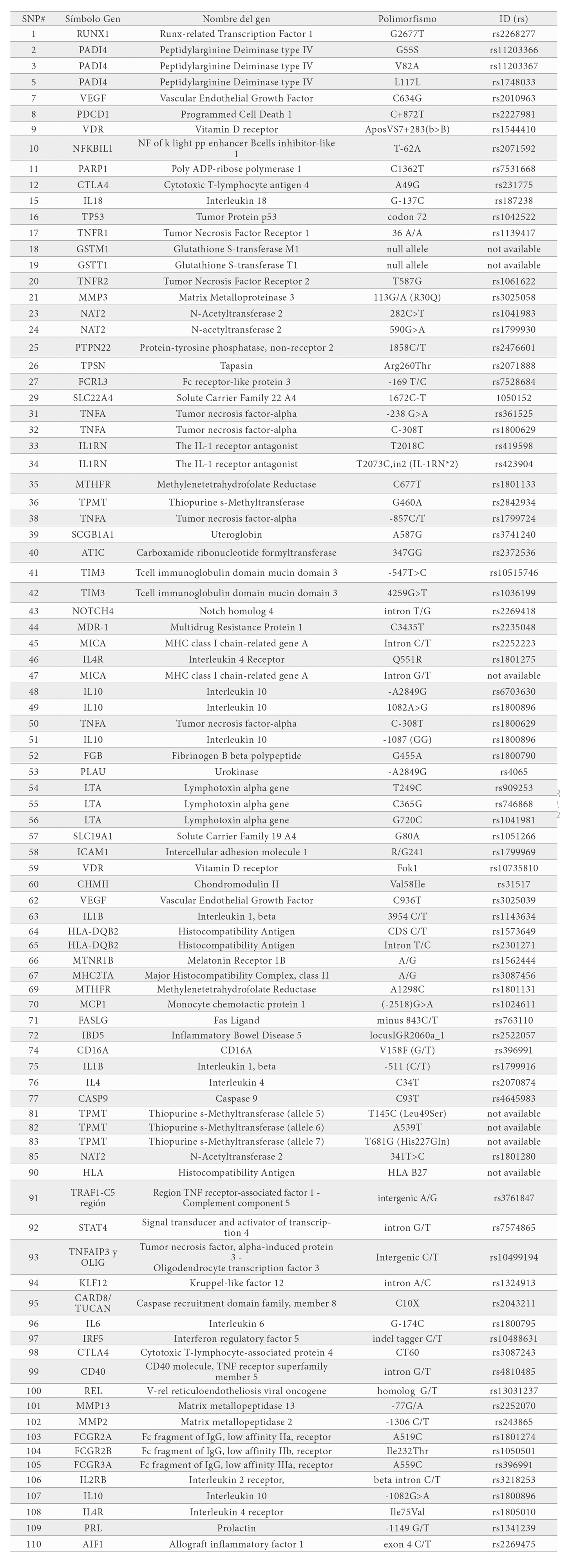
El genotipado de SNP se llevó a cabo utilizando un nuevo microarray de ADN de baja densidad desarrollado basado en sondas específicas de alelo y siguiendo el proceso descrito previamente por Balsa y colaboradores (10). Este microarray permite el análisis simultáneo de 110 SNPs en 67 genes que han sido seleccionados por su potencial impacto en la AR según la literatura publicada hasta el momento (Tabla 1).
El diseño, la fabricación, la validación y el análisis del microarray de ADN se realizó de acuerdo con el procedimiento descrito por Tejedor y colaboradores con mínimas modificaciones (11). Primero se realiza la extracción del ADN de una muestra de sangre periférica utilizando un Minikit de sangre de DNA QIAamp (Qiagen) siguiendo las instrucciones de manufacturación descritas y posteriormente la amplificación del ADN de interés se lleva a cabo en varias reacciones de PCR Multiplex. Los productos de PCR se marcaron con fluorescencia y se hibridaron con el microarray en una plataforma automatizada (Ventana Medical Systems, Tucson, AZ, EEUU). Finalmente se escanearon los microarrays (Innopsys S.A., Carbonne, Francia) y se determinaron los genotipos de SNP utilizando el software de genotipado MG 1.0 (11). El genotipado de HLA-DRB1 se realizó utilizando el método de sonda de oligonucleótidos específica de secuencia (SSO) utilizando la prueba de tipificación LABType SSO DRB1 (One Lambda, Canoga Park, CA, EEUU) y un analizador de flujo, Luminex 200.
El microarray de ADN permite el genotipado simultáneo de 110 SNP en 67 genes incluido el polimorfismo A587G (rs3741240) en el gen de la uteroglobina, el polimorfismo 113-/A (rs3025058) en el gen de la MMP3, el polimorfismo C4599T (rs3218253) en el gen del IL2RB, el polimorfismo C872T (rs2227981) en el gen del PDCD1, el polimorfismo A1969G (rs1801275) en el gen del IL4R y el polimorfismo C1672T (rs1050152) en el gen del SLC22A4. Finalmente se escanearon los microarrays y se determinaron los genotipos de los SNPs utilizando el software de genotipado MG 1.0.
Análisis estadístico
Los análisis estadísticos se realizaron utilizando los softwares Helix TreeTM v6.4.2 (Golden Helix Inc., Bozeman, Montana, EEUU) y el SPSS v15.0 (SPSS, Chicago, IL, EEUU). El umbral de significación estadística se predefinió como un valor de p<0.05. Se realizó una prueba de desviación del equilibrio de Hardy-Weinberg (HWE) para cada SNP. Las pruebas de asociación se realizaron mediante el test de Chi-Cuadrado (X²). La magnitud de la asociación se expresó como odds ratio (OR) con un intervalo de confianza (IC) del 95%. Se construyeron haplotipos y se estimaron frecuencias utilizando el algoritmo de maximización de expectativas. La asociación entre las frecuencias de haplotipos y el daño articular se evaluó mediante la prueba de Chi-Cuadrado. Las asociaciones de las variables demográficas y clínicas con el daño articular se analizaron mediante la prueba de la t de Student, la prueba de la U de Mann-Whitney o la prueba de la Chi-Cuadrado según la variable probada.
RESULTADOS
La cohorte del estudio incluyó a 632 pacientes españoles con AR (Tabla 2) con una edad media de inicio de la enfermedad de 49.6 ± 13.5 años (medias ± S.E.) y un tiempo medio de evolución desde el inicio de la enfermedad de 10.8 ± 4.7 años. Al inicio de la enfermedad la media de articulaciones dolorosas es de 9.9 ± 6.9, la VSG 41.1 ± 26.3, la PCR 4.2 ± 7.7, el FR 196.6 ± 301.3 y los ACPA 458.2 ± 563.6. De los 632 pacientes con AR tenemos datos de recuento de erosiones en 604 de ellos e información de cirugía en unos 616. Un total del 30% de ellos (n=182) presentan erosiones múltiples en manos y en pies (fenotipo RX2) y el 20.9% (n=129) se sometió a algún tipo de cirugía (cualquier intervención articular incluyendo la prótesis).
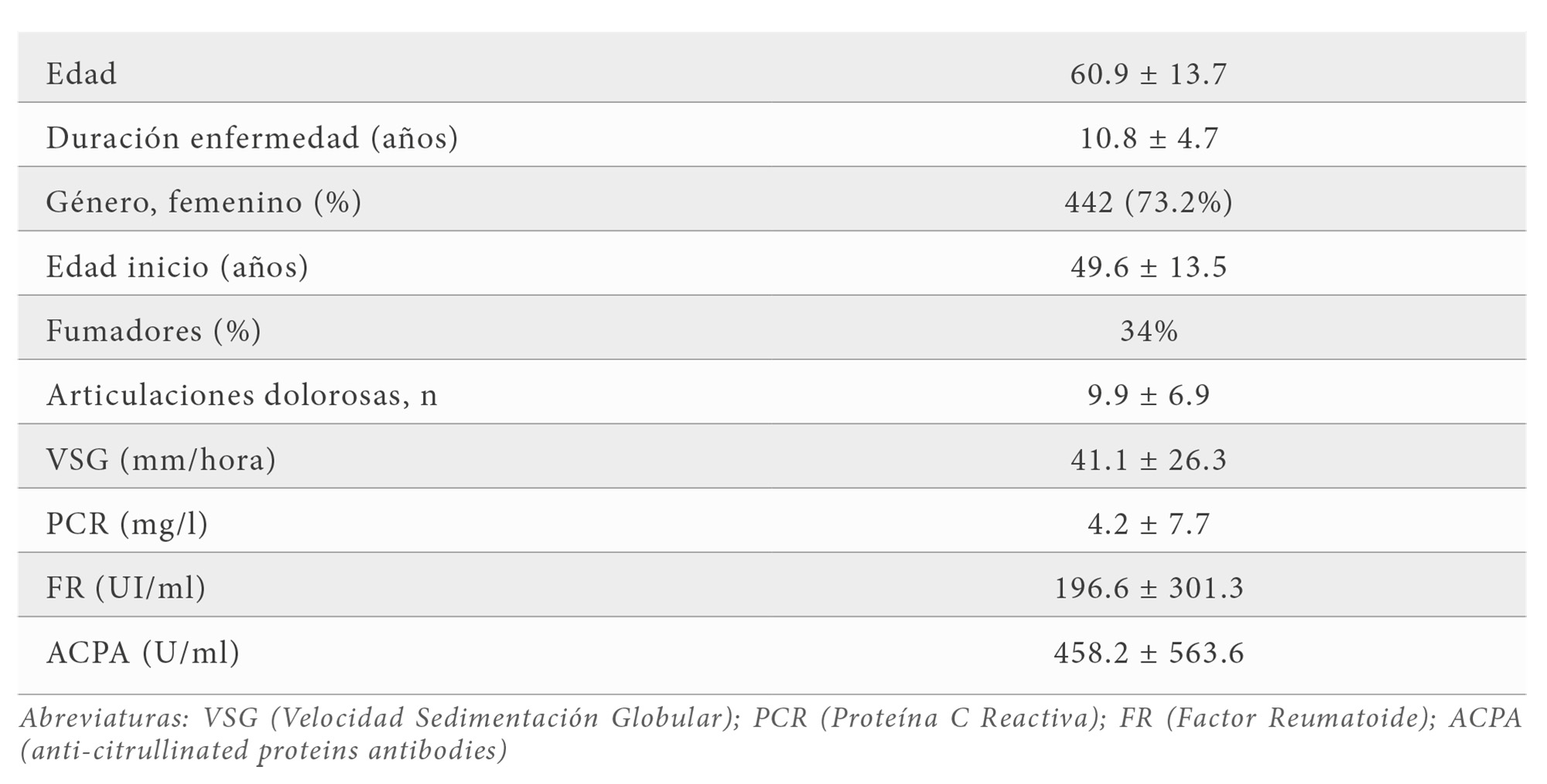
De todas las variables clínicas y analíticas 6 de ellas se asociaron con el fenotipo RX2. Dichas variables fueron la edad, la duración de la enfermedad, el número de articulaciones dolorosas, la VSG, FR y ACPA; sin embargo tanto la edad de inicio como la PCR no mostraron ningún tipo de asociación (Tabla 3). Por otro lado la cirugía se asoció significativamente con 3 variables analíticas (PCR, VSG y ACPA) y 2 variables clínicas (número de articulaciones dolorosas y duración de la enfermedad) (Tabla 4).
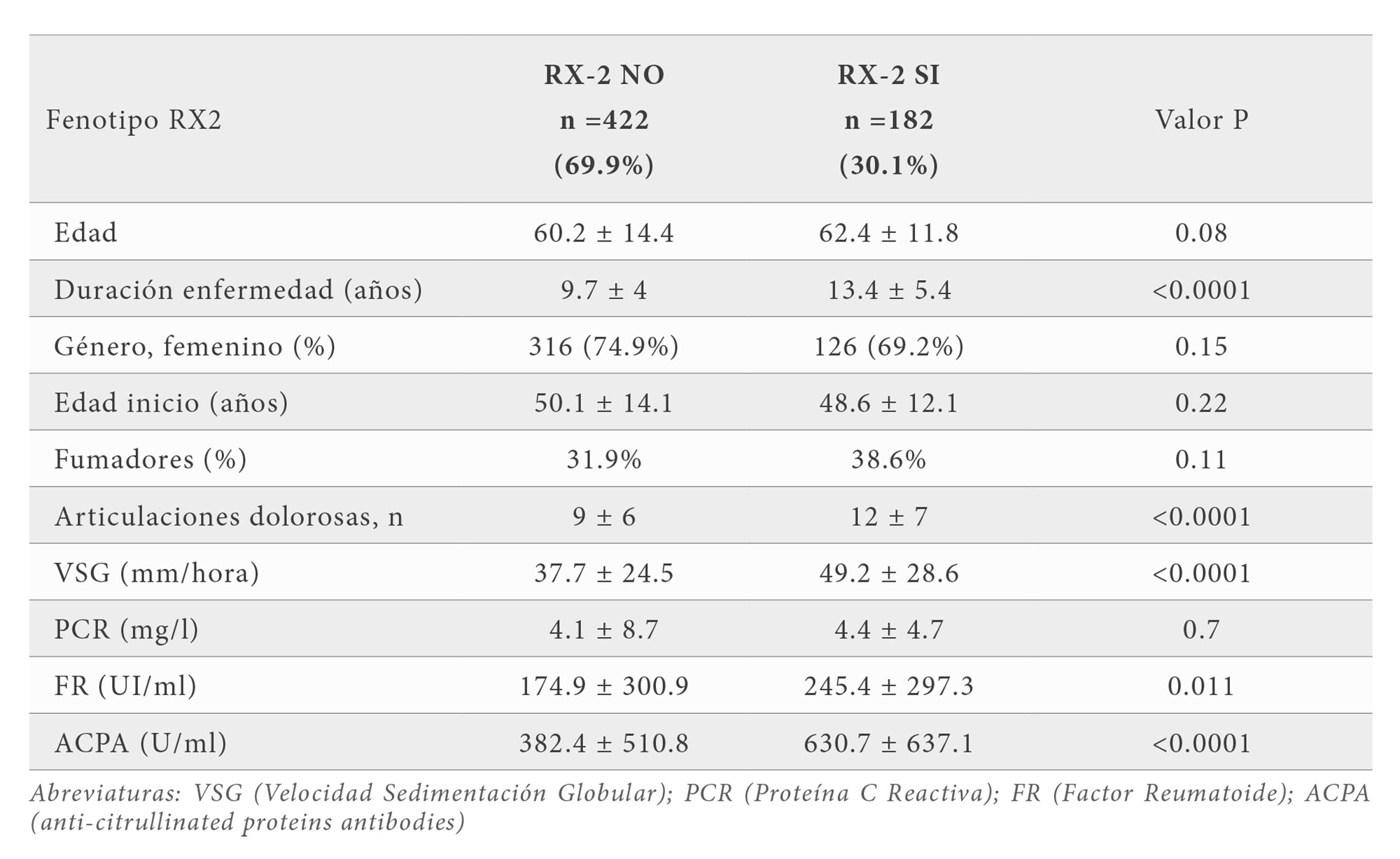
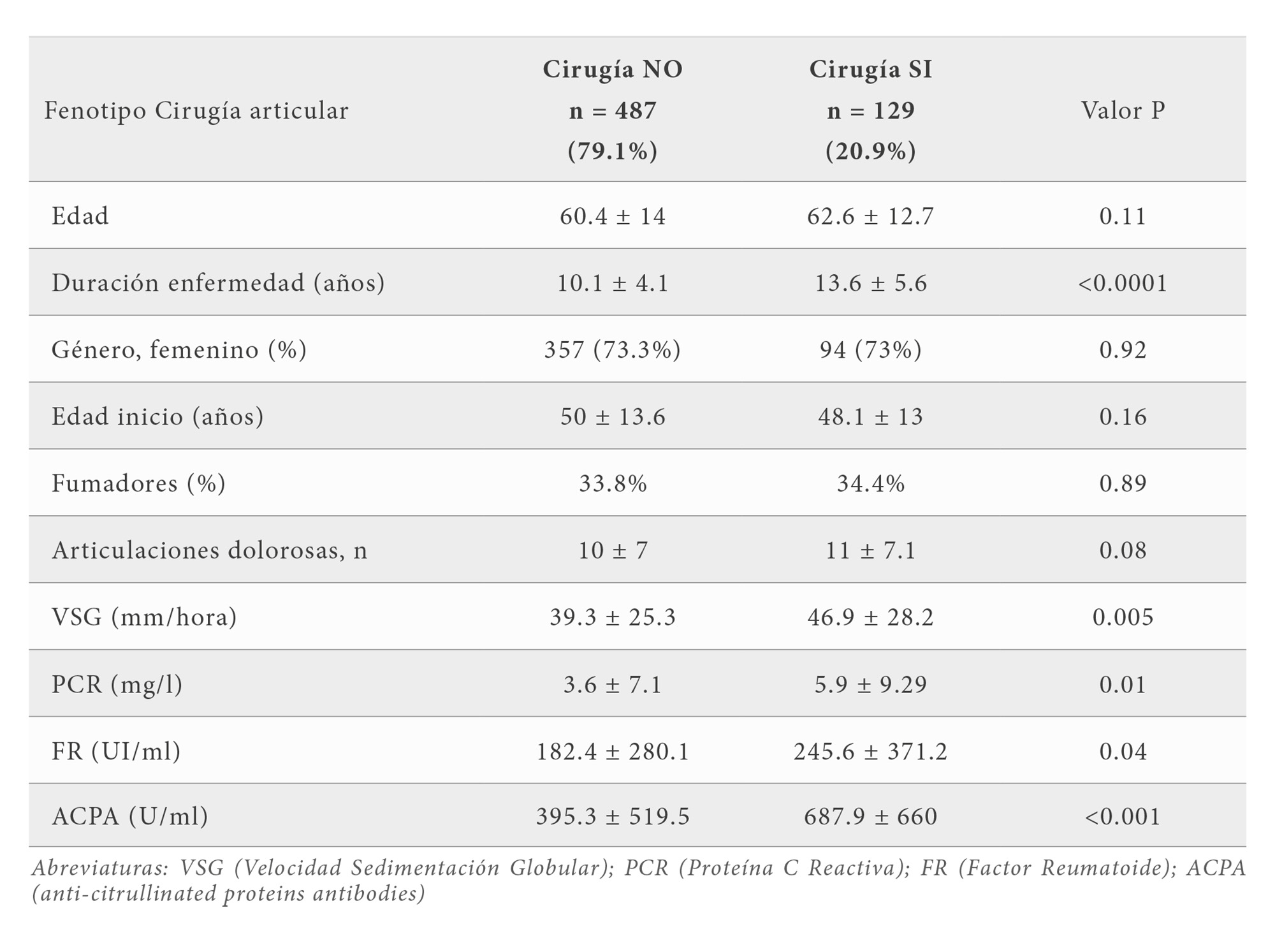
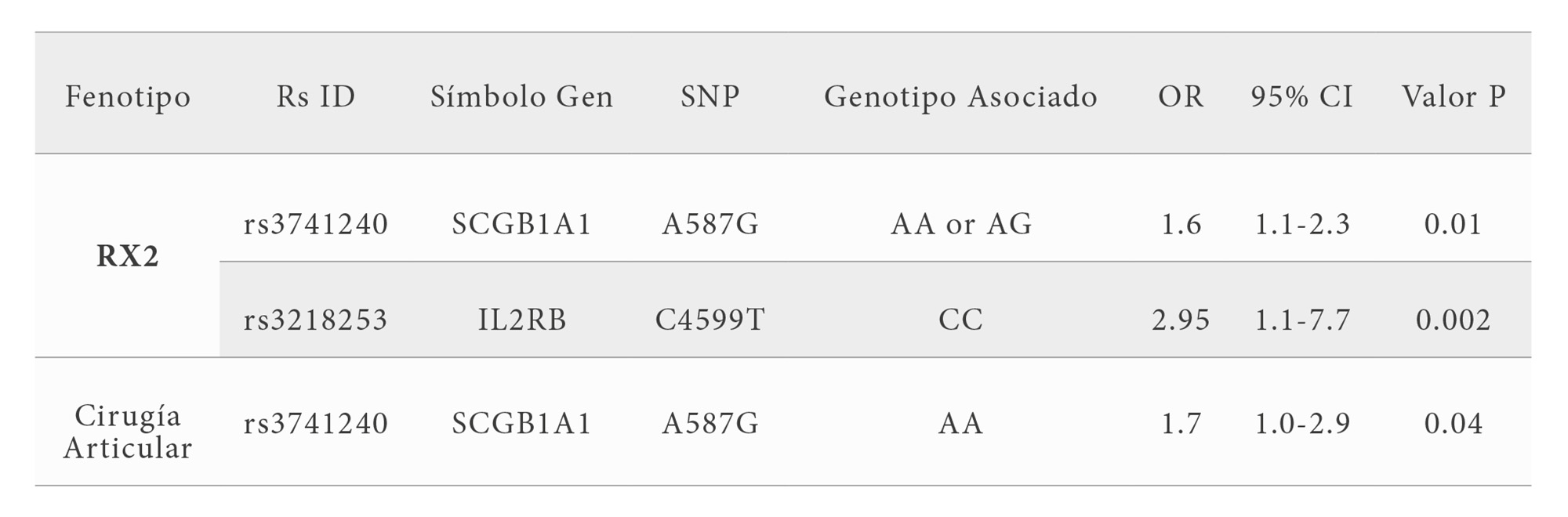
De los 89 SNPs estudiados encontramos que 2 SNPs se asociaron con el fenotipo RX2 (en los genes SCGB1A1 e IL2RB). Este análisis identificó que la frecuencia del alelo AG del gen de la uteroglobina (rs3741240, A587G) (OR 1.6; IC 95% 1.1-2.3) y el SNP (rs3218253, C4599T) del gen IL2RB se asocian significativamente con el fenotipo RX2 (OR 2.95; IC 95% 1.1-7.7) (Tabla 5). La cirugía mostró también una asociación positiva con el SNP (rs3741240, A587G) ubicado en el gen de la uteroglobina (OR 1.7; IC 95% 1.0-2.9). Los alelos más frecuentemente asociados son AA para el gen de la uteroglobina (Cuadro 5).
DISCUSIÓN
Nuestros datos identificaron que la presencia de un SNP dentro del locus del gen de la uteroglobina (rs3741240) está asociado con el daño radiológico en la Artritis Reumatoide ocasionando el desarrollo de múltiples erosiones en manos y pies y la necesidad de cirugía. De manera similar un SNP dentro del locus del gen IL2RB (rs3218253) está significativamente asociado con el desarrollo de múltiples erosiones en manos y pies.
En nuestro trabajo hemos definido el daño articular en función de la presencia o ausencia de erosiones en manos y pies y la cirugía articular. En base a estos elementos definimos estos dos fenotipos denominados RX2 (erosiones múltiples en manos y pies) y cirugía (cualquier intervención articular incluyendo las prótesis). Para mejorar el método de clasificación utilizado por nosotros, en la evaluación de la afectación articular se designó previamente si existía una buena correlación con los sistemas existentes acreditados hasta el momento como el método Larsen; de lo contrario nuestro sistema sería inútil para la evaluación del daño conjunto (12, 13, 14). El método de Larsen evalúa las erosiones e interlínea de forma global en 16 áreas de las manos y pies puntuando cada zona de 0 a 5 y la puntuación puede oscilar entre 0 y 160. Finalmente constatamos una correlación entre los dos sistemas de evaluación con un resultado estadísticamente significativo (p<0.001). En aquellos pacientes en los que teníamos menos erosiones o ausencia de las mismas la puntuación Larsen era mucho más baja que en los pacientes en los que el número de erosiones era mayor (Figura 1).
Analizamos estos fenotipos en un total de 632 pacientes con AR y detectamos un grupo de polimorfismos y variables clínicas y de laboratorio que se asociaron al daño radiológico en los dos fenotipos diferentes estudiados (RX2 y cirugía). Postulamos así con nuestros datos la asociación del gen de la uteroglobina con el daño radiológico. La uteroglobina es una proteína con una estructura similar a las citoquinas ubicada en el gen SCGB1A1 y la cual tiene propiedades inmunomoduladoras y antiinflamatorias (inhibe PLA2, quimiotaxis y fagocitosis). Es producida por las células epiteliales de la mucosa del pulmón, del útero y de la próstata y se cataboliza en los túbulos renales proximales.
Como ocurre con la mayoría de los polimorfismos el SNP analizado en este estudio (A587G) se encuentra en un área que regula la transcripción génica. Diferentes SNPs de esta proteína se asociaron en estudios previos con otras enfermedades como el asma y la nefropatía por IgA (15). En algunos de estos trabajos se sugiere incluso que los portadores del alelo A producían niveles más bajos de uteroglobina (16). Otros trabajos afirman que la presencia de 2 alelos A (la homocigosidad o genotipo AA) se asocia sin embargo con una menor severidad de la AR (17) y resultando altamente protectora para el desarrollo de erosiones. La presencia de al menos un alelo variante que contenga una G en esta posición predecía una enfermedad más grave.
En contraste con esto nuestros resultados sugieren que los pacientes con 2 alelos A (genotipo AA) tienen un mayor riesgo de desarrollar erosiones múltiples (fenotipo RX2) y requerir una cirugía articular que los pacientes con genotipo GG homocigoto. De hecho el alelo A confiere por si mismo gravedad al modelo y por lo tanto la frecuencia de erosiones radiológicas múltiples en manos y pies fue significativamente menor en pacientes con genotipo GG homocigoto.
En esta línea Menegatti E. y colaboradores demostraron que el análisis de la frecuencia de genotipos del gen de la uteroglobina mostró un aumento en los genotipos GA y AA del polimorfismo c.38G>A en los pacientes en comparación con los controles y los cuales tienen un mayor riesgo de desarrollar una enfermedad del tejido conectivo tisular (artritis reumatoide y vasculitis sistémica) (18).
Kim YS sugiere que el polimorfismo en la uteroglobina (38th nucleótido A a G) es un marcador importante para la progresión otras patologías como la nefropatía por inmunoglobulina A y además puede modular el nivel de expresión de la proteína. El riesgo de progresión de la enfermedad aumentó a medida que se incrementaba el número de alelos A y la razón de probabilidad de progresión con el genotipo AA era mayor en comparación con los pacientes que mostraban el genotipo GG (4.9; 95% IC =1.0-23.9) (19).
La interleucina-2 (IL-2) es una citocina pleiotrópica que impulsa el crecimiento de las células T, aumenta la actividad citolítica de las NK (Natural Killer), induce la diferenciación de células T reguladoras y media la muerte celular inducida por activación (20). La asociación de IL2RB con la artritis reumatoide fue ya estudiada previamente y más recientemente también se descubrió que la región IL2RA está asociada con otras enfermedades autoinmunes como la esclerosis múltiple y la diabetes tipo 1 (21).
Entre las variables clínicas y de laboratorio de nuestro estudio identificamos su asociación con los fenotipos de daño estructural y cirugía algunas tales como la duración de la enfermedad, el número de articulaciones dolorosas, la VSG basal, los títulos de FR y los títulos de ACPA. Varios estudios previos hacen ya referencia al valor pronóstico de estas variables clínicas y de laboratorio como es el caso de los anticuerpos ACPA (22). Los ACPA ya fueron analizados en múltiples estudios previos donde se encontró su asociación con el daño estructural en la evolución de la enfermedad, así como con el factor antiperinuclear (23). Ambos demostraron su superioridad global frente a los anticuerpos anti-antiqueratina (tres variantes de los péptidos anti-citrulinados) (24, 25, 26). Algún trabajo no pudo demostrar con total claridad si el curso clínico de la enfermedad (aparte del daño estructural) podría estar influenciado por ser o no ACPA positivo (27). En nuestro proyecto observamos la asociación del daño radiológico y los títulos de ACPA, así como otros factores de laboratorio como el FR y VSG alta, en el momento del diagnóstico.
Los cambios radiográficos estadísticamente significativos se han asociado con niveles séricos de diferentes isoformas del FR como la IgA, IgM e IgG (28, 29). De hecho hay trabajos de mas de 10 años al respecto, aunque pocos cuando tratamos de analizar la potencia de cada isoforma.
Múltiples estudios recientes indican que la relación existente entre ACPA, FR y daño radiológico parece ser completamente independiente (30), pero la superioridad de ACPA sobre los otros marcadores parece clara en todo lo discutido hasta ahora. En nuestro proyecto aunque ACPA y FR son significativos, los primeros quedan patentes como más relevantes (p <0.001 versus p <0.004). La VSG elevada al inicio parece predecir un mal resultado desde el punto de vista del daño articular (31, 32); resultado que concuerda con algunos estudios previos a corto (33, 34, 35, 36) y largo plazo (37, 38, 39). Un aspecto interesante de nuestros datos como en otros trabajos, es que no pudimos demostrar una relación entre el daño articular y la PCR (40). El papel de los parámetros clínicos y de laboratorio tales como el sexo, la edad o el número de articulaciones dolorosas e inflamadas se discutió en varios estudios a corto plazo, pero los resultados fueron entre ellos contradictorios. En nuestro proyecto el número de articulaciones dolorosas y la duración de la enfermedad aparecen relacionadas con el daño estructural.
Nuestro trabajo tiene las siguientes limitaciones: 1) Es un estudio de asociación y no se puede concluir que haya causalidad. 2) Hemos utilizado un microarray que permite el análisis simultáneo de 110 SNPs en 67 genes que han sido seleccionados por su potencial impacto en la AR según la literatura publicada hasta el momento. Actualmente existen microarrays con mayor numero de SNPs.3) No se han replicado los resultados en otra cohorte.
CONCLUSIONES
Consideramos que la genética de la artritis reumatoide al igual que en otras enfermedades reumáticas está variando significativamente en el conocimiento en estos últimos años (41). El desarrollo de instrumentos como el que hemos presentado está en constante evolución y esta es una de las líneas en la que debemos seguir trabajando para encontrar un modelo que nos permita realizar un diagnóstico precoz, conocer el pronóstico de la enfermedad y poder aplicar terapias más precisas (alta eficacia y baja toxicidad). Del amplio número de genes analizados en este estudio, nosotros proponemos los genes de la Uteroglobina e IL2R respectivamente, los cuales se podrían unir a la Prostaglandin E receptor 4 (PTGER4) (42) como candidatos para predecir el daño radiológico en una población española con Artritis Reumatoide.
DECLARACIÓN DE TRANSPARENCIA
Los autores/as de este artículo declaran no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
BIBLIOGRAFÍA
- ↑Welsing PM, Landewe RB, van Riel PL et al . The relationship between disease activity and radiologic progression in patients with rheumatoid arthritis: a longitudinal analysis. Arthritis Rheum. 2004; 50(7): 2082-2093.
- ↑Landewe R. Predictive markers in rapidly progressing rheumatoid arthritis. J Rheumatol Suppl. 2007; 80(11): 8-15.
- ↑Visser H, le Cessie S, Vos K, Breedveld FC, Hazes JM. How to diagnose rheumatoid arthritis early: a prediction model for persistent (erosive) arthritis. Arthritis Rheum. 2002; 46(2): 357-365.
- ↑Brennan P, Harrison B, Barrett E et al. A simple algorithm to predict the development of radiological erosions in patients with early rheumatoid arthritis: Prospective cohort study. BMJ. 1996; 313(7055):471-476.
- ↑Brennan FM, McInnes IB. Evidence that cytokines play a role in rheumatoid arthritis. J Clin Invest. 2008; 118(11): 3537-3545.
- ↑Brinkman BM, Huizinga TW, Kurban SS et al. Tumor necrosis factor alpha gene polymorphisms in rheumatoid arthritis: Association with susceptibility to, or severity of disease? Br J Rheumatol. 1997; 36 (5): 516-521.
- ↑Verweij CL. Tumour necrosis factor gene polymorphisms as severity markers in rheumatoid arthritis. Ann Rheum Dis. 1999; 58(Suppl 1): 120-126.
- ↑Buchs N, Di Giovine FS, Silvestre T, Vannier E, Duff GW, Miossec P. IL-1 β and IL-1Ra gene polymorphisms and disease severity in rheumatoid arthritis: Interaction with their plasma levels. Genes Immun. 2001; 2(4): 222-228.
- ↑Farago Bernadett, Talian GC, Komlosi K et al. Protein tyrosine phosphatase gene C1858T allele confers risk for rheumatoid arthritis in Hungarian subjects. Rheumatol Int. 2008; 29: 793-796.
- ↑Balsa A, Del Amo J, Blanco F et al. Prediction of functional impairment and remission in rheumatoid arthritis patients by biochemical variables and genetic polymorphisms. Rheumatology (Oxford). 2010; 49(3):458-466.
- ↑Tejedor D, Castillo S, Mozas P et al. Reliable low-density DNA array based on allele-specific probes for detection of 118 mutations causing familial hypercholesterolemia. Clin Chem. 2005; 51: 1137-1144.
- ↑Larsen A, Dale K, Eek M. Radiographic evaluation of rheumatoid arthritis and related conditions by reference films. Acta Radiol Diagn. 1977; 18: 481-491.
- ↑Larsen A, Edgren J, Harju E, Laasonen L, Reitamo T. Interobserver variation in the evaluation of radiologic changes of rheumatoid arthritis. Scand J Rheumatol. 1979; 8: 109-112.
- ↑Larsen A. How to apply Larsen score in evaluating radiographs of rheumatoid arthritis in long-term studies. J Rheumatol.1995; 22(10): 1974-1975.
- ↑Shijubo N, Kawabata I, Sato N, Itoh Y. Clinical aspects of Clara cell 10-kDa protein/ uteroglobin (secretoglobin 1A1). Curr Pharm Des. 2003; 9(14): 1139-1149.
- ↑Mukherjee AB, Kundu GC, Mantile-Selvaggi G et al. Uteroglobin: a novel cytokine?. Cell Mol Life Sci. 1999; 55(5): 771-787.
- ↑Goronzy JJ, Matteson EL, Fulbright JW et al. Prognostic markers of radiographic progression in early rheumatoid arthritis. Arthritis Rheum. 2004; 50(1): 43-54.
- ↑Menegatti E, Davit A, Francica S et al. Genetic factors associated with rheumatoid arthritis and systemic vasculitis: Evaluation of a panel of polymorphisms. Dis Markers. 2009; 27(5): 217-223.
- ↑Kim YS, Kang D, Kwon DY et al. Uteroglobin gene polymorphisms affect the progression of immunoglobulin A nephropathy by modulating the level of uteroglobin expression. Pharmacogenetics. 2001; 11(4): 299-305.
- ↑Liao W, Lin JX, Leonard WJ. IL-2 family cytokines: New insights into the complex roles of IL-2 as a broad regulator of T helper cell differentiation. Curr Opin Immunol. 2011; 23(5): 598-604.
- ↑Kurreeman FA, Daha NA, Chang M et al. Association of IL2RA and IL2RB with rheumatoid arthritis: a replication study in a Dutch population. Ann Rheum Dis. 2009; 68(11): 1789-1790.
- ↑De Rycke L, Peene I, Hoffman IE et al. Rheumatoid factor and anticitrullinated protein antibodies in rheumatoid arthritis: Diagnostic value, associations with radiological progression rate, and extra-articular manifestations. Ann Rheum Dis. 2004; 63(12): 1587-1593.
- ↑Ewa Berglin, Leonid Padyukov, Ulf Sundin et al. A combination of autoantibodies to cyclic citrullinated peptide (CCP) and HLA-DRB1 locus antigens is strongly associated with future onset of rheumatoid arthritis. Arthritis Res Ther. 2004; 6(4): R303-R308.
- ↑Meyer O, Labarre C, Dougados M et al. Anticitrullinated protein/peptide antibody assays in early rheumatoid arthritis for predicting five year radiographic damage. Ann Rheum Dis. 2003; 62(2): 120-126.
- ↑Nielen MM, van der Horst AR, van der Horst-Bruinsma IE et al. Antibodies to citrullinated human fibrinogen (ACF) have diagnostic and prognostic value in early arthritis. Ann Rheum Dis. 2005; 64(8): 1199-1204.
- ↑Van der Woude D, Syversen SW, van der Voort EI et al. The ACPA isotype profile reflects long-term radiographic progression in rheumatoid arthritis. Ann Rheum Dis. 2010; 69(6):1110-1116.
- ↑Van der Helm-van Mil AH, Verpoort KN, Breedveld FC, Toes RE, Huizinga TW. Antibodies to citrullinated proteins and differences in clinical progression of rheumatoid arthritis. Arthritis Res Ther. 2005; 7(5): R949-R958.
- ↑Ahmed MM, Obaid Al-Ruhaimi KA, Mohammed SH. Evaluation of the rheumatoid factors of the IgG, IgM and IgA isotypes as prognostic parameters for rheumatoid arthritis among Iraqi patients. Indian J Pathol Microbiol. 2010; 53(3): 439-444.
- ↑Berglin E, Johansson T, Sundin U et al. Radiological outcome in rheumatoid arthritis is predicted by presence of antibodies against cyclic citrullinated peptide before and at disease onset, and by IgA-RF at disease onset. Ann Rheum Dis. 2006; 65(4): 453-458.
- ↑Mewar D, Coote A, Moore DJ et al. Independent associations of anti-cyclic citrullinated peptide antibodies and rheumatoid factor with radiographic severity of rheumatoid arthritis. Arthritis Res Ther. 2006; 8(4): R128.
- ↑Lindqvist E, Jonsson K, Saxne T, Eberhardt K. Course of radiographic damage over 10 years in a cohort with early rheumatoid arthritis. Ann Rheum Dis. 2003; 62(7): 611-616.
- ↑Drossaers-Bakker KW, de Buck M, van Zeben D, Zwinderman AH, Breedveld FC, Hazes JM. Long-term course and outcome of functional capacity in rheumatoid arthritis: the effect of disease activity and radiologic damage over time. Arthritis Rheum. 1999; 42(9): 1854-1860.
- ↑Combe B, Dougados M, Goupille P et al. Prognostic factors for radiographic damage in early rheumatoid arthritis: a multiparameter prospective study. Arthritis Rheum. 2001; 44(8): 1736-1743.
- ↑Guillemin F, Gérard N, van Leeuwen M, Smedstad LM, Kvien TK, van den Heuvel W; EURIDISS Group. Prognostic factors for joint destruction in rheumatoid arthritis: a prospective longitudinal study of 318 patients. J Rheumatol. 2003; 30(12): 2585-2589.
- ↑Dixey J, Solymossy C, Young A; Early RA Study. Is it possible to predict radiological damage in early rheumatoid arthritis?: a report on the occurrence, progression and prognostic factors of radiological erosions over the first three years in 866 patients from the Early RA Study (ERAS). J Rheumatol Suppl. 2004; 69: 48-54.
- ↑Valenzuela-Castaño A, García-López A, Pérez-Vilches D, Rodríguez-Pérez R, González-Escribano MF, Núñez-Roldán A. The predictive value of the HLA shared epitope for severity of radiological joint damage in patients with rheumatoid arthritis: a 10 year observational prospective study. J Rheumatol. 2000; 27(3): 571-574.
- ↑Kaarela K. Prognostic factors and diagnostic criteria in early rheumatoid arthritis. Scand J Rheumatol. 1985; 57 :1-54.
- ↑Syversen SW, Gaarder PI, Goll GL et al. High anti-cyclic citrullinated peptide levels and an algorithm of four variables predict radiographic progression in patients with rheumatoid arthritis: results from a 10-year longitudinal study. Ann Rheum Dis. 2008; 67(2): 212-217.
- ↑Wolfe F, Sharp JT. Radiographic outcome of recent-onset rheumatoid arthritis: a 19-year study of radiographic progression. Arthritis Rheum. 1998; 41(9): 1571-1582.
- ↑Courvoisier N, Dougados M, Cantagrel A et al. Prognostic factors of 10-year radiographic outcome in early rheumatoid arthritis: a prospective study. Arthritis Res Ther. 2008; 10(5): R106.
- ↑Marinou I, Maxwell JR, Wilson AG. Genetic influences modulating the radiological severity of rheumatoid arthritis. Ann Rheum Dis. 2010; 69(3): 476-482.
Francisco J. Blanco
Servicio de Reumatologia. Hospital Universitario A Coruña
C/As Xubias, S/N · 15006 A Coruña, Spain
Tlf.: +34 981 17 63 99 | E-Mail: fblagar@sergas.es
Enviado: 21.02.23
Revisado: 05.03.23
Aceptado: 25.03.23


