Resumen
El mayor factor de riesgo para procesos neurodegenerativos, como la enfermedad de Alzheimer, es el envejecimiento. A nivel molecular, el envejecimiento, tanto de tejidos periféricos como del sistema nervioso, se relaciona con cambios epigenéticos en la cromatina (histonas y DNA). Se ha observado que estos cambios pueden revertirse tras la expresión de los denominados factores de Yamanaka (YF), reprogramándose (rejuveneciendo) las células envejecidas y, en el caso del sistema nervioso, mejorando la capacidad cognitiva de ratones viejos. Como objetivo para el futuro se planea extrapolar los resultados obtenidos en modelos de ratón al ser humano, sustituyendo los YF por compuestos simples y de pequeño tamaño, que puedan revertir los cambios estructurales y funcionales dependientes del envejecimiento.
Abstract
The main risk factor for neurodegenerative disorders, like Alzheimer disease, is aging. At molecular level, aging correlates, in peripheral tissues and in the central nervous system with epigenetic changes at the chromatin (histones and DNA) of aged cells. These molecular changes can be reverted by the expression of the, so called, Yamanaka factors (YF). YF can reprogram (rejuvenate) old cells to cells with structural and functional characteristics of young cells. In the case of the nervous system, upon YF expression, an increase in cognitive capacity can be found. Our future objective, to extrapolate the results found in mice to the human being, will be to look for simple and small chemical compounds with a similar capacity, to that of YF, to revert the structural and functional changes found during aging development.
Palabras clave: Envejecimiento; Heterocromatina; Neurona; Factores de Yamanaka; Memoria.
Keywords: Aging; Heterochromatin; Neuron; Yamanaka Factors; Memory.
INTRODUCCIÓN
Los avances médicos de las últimas décadas han dado lugar a un alargamiento de la vida media del ser humano. Sin embargo, este aumento en años no se corresponde con un mantenimiento de la calidad de vida que podría corresponder con una longevidad saludable. De hecho, ese aumento de la vida media supone un mayor tiempo experimentando el envejecimiento, que es el mayor factor de riesgo de procesos degenerativos, tanto en la periferia como en el sistema nervioso central de los humanos. Sin embargo, el tipo de longevidad no es homogéneo y existen diferentes tipos de envejecimiento con diferentes grados de calidad de vida. Ello ha dado lugar a la disciplina médica conocida como Geriatría, discutiéndose si el envejecimiento puede ser considerado, o no, como enfermedad. La Organización Mundial de la Salud (WHO de sus siglas en inglés) en su décimo primera revisión internacional de clasificación de las enfermedades, suprimió el concepto envejecimiento como enfermedad, indicando que la vejez es un proceso normal, por el que todos pasamos, mientras que la enfermedad es un estado por el que solo pasan algunos [1]. De este modo la WHO reemplazó el término “vejez” por el más largo “disminución de la capacidad intrínseca asociada al envejecimiento”, para indicar las disfunciones asociadas al proceso. Como se indica en la referencia arriba indicada [1], el considerar, o no, la vejez como enfermedad, parece ser más bien un conflicto lingüístico que enmascara uno previo, ideológico, entre la Ciencia de la Longevidad y la Medicina Geriátrica.
El objetivo de este breve artículo es comentar sobre los posibles mecanismos que dan lugar a que un órgano funcional (joven) se vaya convirtiendo, con el aumento en años, en un organismo disfuncional (viejo). Se focalizará en la disfunción, asociada al envejecimiento, en procesos, como la memoria episódica, llevados a cabo en regiones del sistema nervioso central. La memoria episódica nos indica que hemos sido y que somos, preparándonos para lo que seremos en el futuro [1].
ENVEJECIMIENTO TISULAR, CELULAR Y MOLECULAR
Suele asumirse que el envejecimiento de un organismo es la suma del envejecimiento de sus tejidos y órganos. Ambos están formados por células diferentes y diferenciadas, que definen la morfología y la función de los diferentes tejidos y órganos. Además, en los diferentes tejidos suele estar presente una población de células (madre o progenitoras) con capacidad de dividirse, proliferar y diferenciarse en los tipos celulares específicos de cada tejido. Estas células madre, una vez diferenciadas, desplazan, por competición celular [2, 3] a las células envejecidas por lo que los tejidos mantienen su morfología y funcionalidad. Sin embargo, cuando las células madre-progenitoras envejecen, el recambio de células viejas por jóvenes disminuye y se produce el envejecimiento del tejido [4, 5].
A nivel celular y molecular, se han indicado varios marcadores del proceso [6]. A nivel molecular, la expresión génica es variable en los diferentes tipos celulares que componen los diferentes tejidos, teniendo estas células diferentes, diferentes vidas medias. Durante el envejecimiento en tejidos específicos, tanto la expresión génica como la vida media celular pueden variar en un tipo específico celular, como se ha indicado en un reciente artículo publicado en estos Anales [7], relacionado con la senescencia de los linfocitos T.
MARCADORES SUBCELULARES DEL ENVEJECIMIENTO
Uno de los cambios más relacionados con el envejecimiento se relaciona con las variaciones epigenéticas que tienen lugar en la cromatina de las células envejecidas. La cromatina puede clasificarse, por su nivel de compactación, en heterocromatina (mayor compactación) y eucromatina, existiendo marcadores para los dos tipos de cromatina, como son las modificaciones, por ejemplo, la metilación, en histonas como H3 o H4, que indican la localización de heterocromatina. También, cambios en la metilación del DNA, relacionados con el envejecimiento, pueden afectar, diferentemente, a las zonas de heterocromatina o de eucromatina. Existe una teoría que relaciona estos cambios con el envejecimiento; la teoría de “La desaparición de la heterocromatina, como modelo de envejecimiento” [8]. Según esta teoría, durante el envejecimiento, la heterocromatina se va descompactando y regiones de DNA que no se transcribían ni traducían, en las células jóvenes, pueden empezar a expresarse en las células viejas (Figura 1A). Ejemplo de estas regiones, silenciadas en las células jóvenes, son las que contienen regiones con secuencias repetidas de DNA [9] que expresan los elementos móviles conocidos como transposones [10, 11]. Estas regiones del DNA, tras la descompactación de la heterocromatina, pueden transcribirse en RNA, y este RNA traducirse en proteínas que pueden contener actividades enzimáticas, como transcriptasa inversa e insertasa (10). Tras la acción de estas dos actividades enzimáticas el RNA puede retrotranscribirse en DNA e insertarse en otra localización cromosómica, diferente de la región en donde estaba localizado. Este proceso, que puede resultar en la pérdida de heterocromatina e inestabilidad genómica, puede evitarse mediante el sistema conocido como PiWi-PiRNA que evita la transcripción y posterior retrotranscripción, inserción y movilidad de los transposones [12], cuyo aumento y movilidad son marcadores de envejecimiento [11].
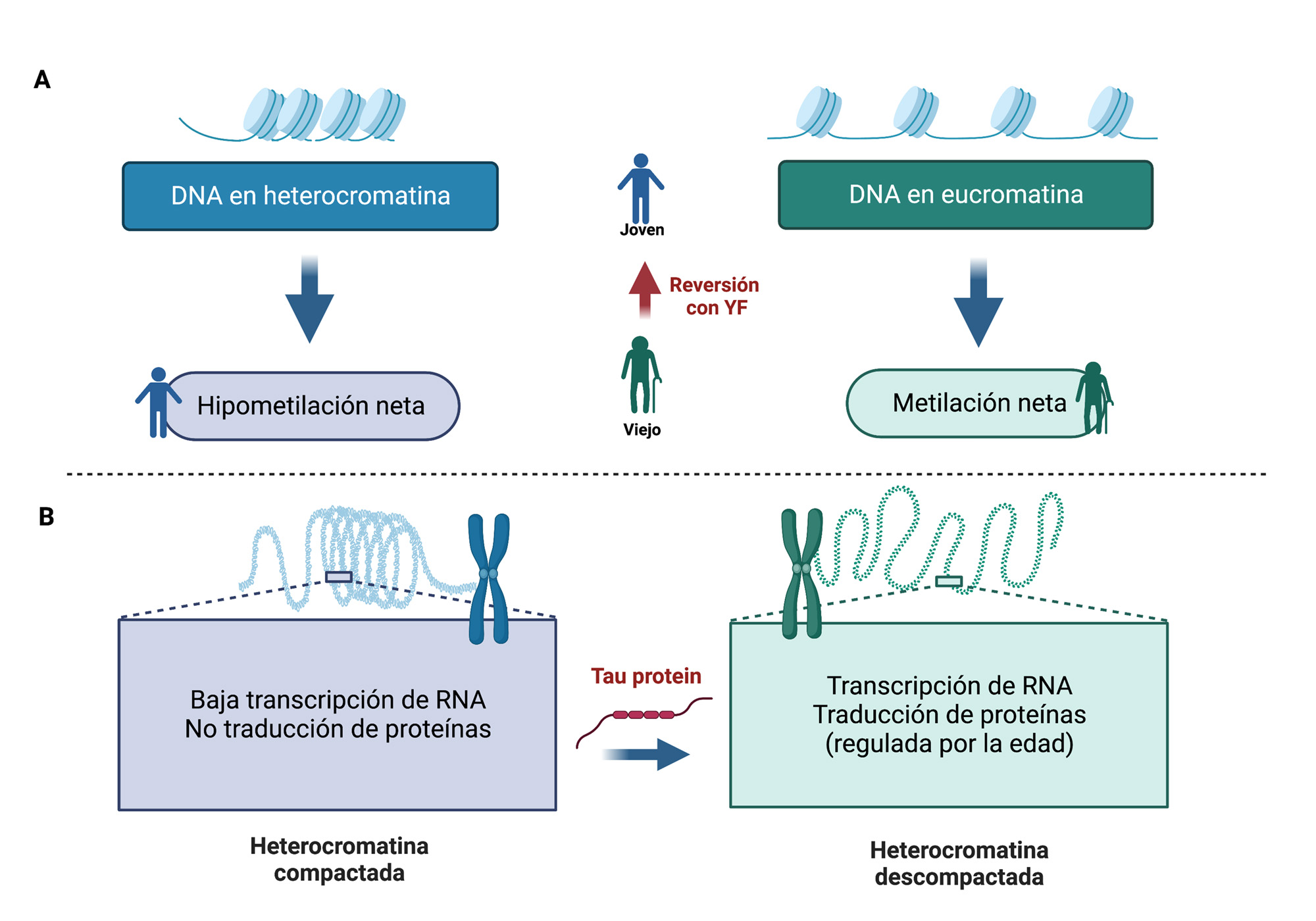
Dado que el proceso de metilación del DNA es una reacción reversible, se ha especulado con que si la metilación del DNA es una causa que promueve el envejecimiento, su reversión podría producir un rejuvenecimiento [14].
Recientemente y mediante la expresión de los denominados factores de Yamanaka (YF) [15], se ha observado que cambios en los niveles de metilación del DNA, promovidos por dichos factores, pueden dar lugar a la reprogramación (rejuvenecimiento) celular [16].
LOS FACTORES DE YAMANAKA PUEDEN REJUVENECER DIFERENTES ÓRGANOS PERIFÉRICOS DE ANIMALES ENVEJECIDOS
El grupo del Prof. Izpisua Belmonte, entre otros, ha publicado que la expresión de los YF en células de ratones viejos da lugar al rejuvenecimiento de la piel, bazo, páncreas y músculo de dichos ratones envejecidos [16], y que dicha reversión funcional se relaciona con cambios epigenéticos, como metilación de histonas y de DNA presentes en la cromatina de las células de los ratones envejecidos.
DIFERENCIAS ENTRE ENVEJECIMIENTO CELULAR DE TEJIDOS PERIFÉRICOS Y DEL SISTEMA NERVIOSO CENTRAL
Mientras una célula epitelial del intestino puede tener una vida media de 3-5 días [17], la vida de una neurona suele ser la de la persona en la que está presente [18]. Sin embargo, en el sistema nervioso central (SNC) existe neurogénesis adulta en regiones del cerebro como el giro dentado, llevándose a cabo el nacimiento de neuronas en dicha región, incluso en nonagenarios (no se han estudiado en centenarios) [19].
Por otra parte, el genoma humano tiene alrededor de 3×109 nucleótidos y 19.969 genes capaces de codificar proteínas [20]. El SNC es la parte del cuerpo humano dónde hay una mayor expresión génica, alrededor de 1/3 de los genes que pueden activarse, y una mayor síntesis de proteínas, comparando con tejidos periféricos [20, 21]. Durante el envejecimiento se producen, tanto en el SNC como en los tejidos periféricos, cambios en la expresión génica.
REJUVENECIMIENTO NEURONAL
Para estudiar, in vivo, en ratones envejecidos, el posible rejuvenecimiento neuronal, y dado lo extenso y complejo que es el SNC, nos centramos en una región específica del cerebro, el giro dentado (GD). La razón para llevar a cabo el análisis en dicha región se basó en la antigua ley titulada “Amnesia retrógrada”, publicada por el neurólogo francés, Ribot, en el siglo XIX [22]. Esta ley sugiere que las memorias recientes desaparecen más rápidamente que algunas antiguas [23] y que las estructuras implicadas en la formación de memorias, que suelen desarrollarse tardíamente, son las que, con la edad, pueden dejar de funcionar más tempranamente [23].
El giro dentado es la región del cerebro en dónde se forma la memoria episódica [24], y es una región que se desarrolla, postnatal, tardíamente, siendo una de las regiones cerebrales que envejecen más rápidamente. De este modo, nuestro objetivo ha sido estudiar el rejuvenecimiento de las neuronas del GD de ratón.
Siguiendo un protocolo similar al utilizado por el grupo del Prof. Izpisua Belmonte, para el rejuvenecimiento de tejido y órganos periféricos [16], y en colaboración con el Prof. M. Serrano, pionero en este tipo de estudios [6], probamos el efecto de los YF en el rejuvenecimiento del GD de ratones viejos. Nuestros resultados indicaron cambios en los niveles de metilación de histonas y de DNA de las células presentes en el GD del ratón envejecido y, lo más importante, una recuperación de su capacidad cognitiva [25]. Actualmente, seguimos estudiando en otros tejidos (neuronas y glia) del cerebro de ratones viejos, el posible efecto regenerativo, tras la expresión de los YF (Anton A. et al, en preparación).
FACTORES NEURONALES, ESPECÍFICOS DEL ENVEJECIMIENTO NEURONAL
Como previamente se ha indicado el SNC es la parte del organismo en dónde se produce una mayor transcripción y traducción de diferentes genes. Ello puede dar lugar a la expresión de proteínas que solo se encuentran en el SNC. En nuestro laboratorio, llevamos tiempo estudiando una proteína neuronal, la proteína asociada a los microtúbulos de neuronas, conocida como proteína tau [26]. Esta proteína tiene un papel relevante en procesos neurodegenerativos, conocidos como taupatías, como la enfermedad de Alzheimer [27, 28]. En estas taupatías, que tienen el envejecimiento como mayor factor de riesgo, la proteína tau presente en neuronas, debido a una disminución de su degradación, puede aumentar su vida hasta 10-30 días [29]. Durante ese largo tiempo, la proteína tau puede sufrir modificaciones (la más relevante es la fosforilación) que pueden cambiar su función (unión de microtúbulos) y formar agregados [30,31,32], que pueden estar formados por diferentes isoformas de tau, y que pueden tener diferentes morfologías en diferentes taupatías [33].
Adicionalmente, durante el envejecimiento, hay también un aumento de tau en los núcleos de las neuronas envejecidas [34]. El tau nuclear se localiza en las regiones heterocromáticas, y puede ayudar a su descompactación con el tiempo [35]. Ello da lugar a la expresión de regiones repetidas de DNA, transposones, proceso que se observa durante el envejecimiento, y que solapa con la enfermedad de Alzheimer [36,37,38]. Estos resultados sugieren una función del tau nuclear, presente en las neuronas envejecidas, en la descompactación de la heterocromatina, permitiendo la expresión de regiones de DNA repetido (Figura 1B). En este proceso, el sistema de silenciamiento de la expresión de transposones parece estar alterado, tras el aumento de tau nuclear (Valles-Saiz et al., pendiente de publicación).
CONCLUSIÓN
Hemos comentado si es posible rejuvenecer neuronas envejecidas, y ello parece posible, en ratón, expresando los YF que pueden producir cambios epigenéticos y de expresión génica que reviertan los cambios epigenéticos y de expresión genética producidos durante el envejecimiento [39, 40].
Sin embargo, no es fácil extrapolar los resultados encontrados en ratón, que implican la manipulación genética requerida para la expresión de YF, a un posible análisis en el ser humano donde esta manipulación genética no puede llevarse a cabo por una cuestión ética. Por ello, para el futuro hay un objetivo común para los grupos trabajando en esta área, tanto en instituciones públicas como en privadas. Este objetivo es reemplazar los YF por compuestos químicos simples y de pequeño tamaño que puedan actuar de igual manera que los YF, en lo referente a los cambios estructurales de la cromatina de células viejas y, sobre todo, en el caso del SNC, en inducir una mayor capacidad cognitiva. Aunque hay trabajo por hacer, algunos compuestos están siendo ya probados [41, 42]. Sin embargo, es importante, en esos análisis, comprobar la ausencia de capacidad oncogénica de esos compuestos que deben de comportarse, no del todo, como los YF, pues uno de ellos, c-myc, es un oncogen [17], por lo que se omite en algunos ensayos. Por ello, también debe omitirse un referente a él, en futuros análisis.
Referente al caso específico del envejecimiento neuronal, regulado por la proteína tau, se ha indicado que un exceso de la proteína en neuronas es tóxico y acelera el envejecimiento. Por otra parte, la proteína tau es importante para determinadas funciones neuronales, no solo es una proteína asociada a los microtúbulos, sino que además tiene otras funciones (ver p.e. referencia [43]). Por ello, se está estudiando cómo conseguir la concentración fisiológica de tau, presente en neuronas jóvenes, que pueda permanecer en células viejas. Recientemente se ha sugerido que la proteína numb, implicada en la señalización de notch, puede actuar como regulador de la cantidad de tau en neuronas, antes del envejecimiento [44] y se sugiere que lo pueda hacer también en neuronas envejecidas.
AGRADECIMIENTOS
Este trabajo ha sido financiado por el Proyecto PID2021-123859OB-I00 a través del MCIN /AEI/10.13039/501100011033 / FEDER, UE. La figura de este artículo ha sido desarrollada en biorender.com. Agradecer la ayuda de Dña. Nuria de la Torre en la edición de este artículo
DECLARACIÓN DE TRANSPARENCIA
El autor/a de este artículo declara no tener ningún tipo de conflicto de intereses respecto a lo expuesto en el presente trabajo.
BIBLIOGRAFÍA
- ↑The Lancet Healthy Longevity. Is ageing a disease? The Lancet Healthy Longevity. 2022; 3: e448.
- ↑Levayer R, Moreno E. Mechanisms of cell competition: Themes and variations. J Cell Biol. 2013; 200: 689-698.
- ↑Liu N, Matsumura H, Kato T. Stem cell competition orchestrates skin homeostasis and ageing. Nature. 2019; 568: 344-350.
- ↑Ahmed AS, Sheng MH, Wasnik S, Baylink DJ, Lau KW. Effect of aging on stem cells. World J Exp Med. 2017; 7: 1-10.
- ↑Rao MS, Mattson MP. Stem cells and aging: Expanding the possibilities. Mech Ageing Dev. 2001; 122: 713-734.
- ↑López-Otin C, Blasco MA, Partridge L, Serrano M, Kroemer G. The hallmarks of aging. Cell. 2013; 153: 194-217.
- ↑Delgado Pulido S, Escrig-Larena J, Mittelbrunn M. T cell senescence: a novel therapeutic target for aging. An RANM. 2022; 139: 150-155.
- ↑Villeponteau B. The heterochromatin loss model of aging. Exp Gerontol. 1997; 32: 383-394.
- ↑Arancio W, Coronnello C. Repetitive sequences in aging. Aging. 2021; 13: 10816-10817.
- ↑Cordaux R, Batzer MA. The impact of retrotransposons on human genome evolution. Nat Rev Genet. 2009; 10: 691-703.
- ↑Sultana T, van Essen D, Siol O. The landscape of L1 retrotransposons in the human genome is shaped by pre-insertion sequence biases and post-insertion selection. Mol Cell. 2019; 74: 555-570 e7.
- ↑Sturm A, Perczel A, Ivics Z, Vellai T. The Piwi-piRNA pathway: Road to immortality. Aging Cell. 2017; 16: 906-911.
- ↑Horvath S, Raj K. DNA methylation-based biomarkers and the epigenetic clock theory of ageing. Nat Rev Genet. 2018; 19: 371-384.
- ↑Noroozi R, Ghafouri-Fard S, Pisarek A. DNA methylation-based age clocks: From age prediction to age reversion. Ageing Res Rev. 2021; 68: 101314.
- ↑Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006; 126: 663-676.
- ↑Ocampo A, Reddy P, Martínez-Redondo P et al. In vivo amelioration of age-associated hallmarks by partial reprogramming. Cell. 2016; 167: 1719-1733 e12.
- ↑Park JH, Kotani T, Konno T et al. Promotion of intestinal epithelial cell turnover by commensal bacteria: Role of short-chain fatty acids. PLoS One. 2016; 11: e0156334.
- ↑Magrassi L, Leto K, Rossi, F. Lifespan of neurons is uncoupled from organismal lifespan. Proc Natl Acad Sci USA. 2013; 110: 4374-4379.
- ↑Moreno-Jiménez EP, Flor-García M, Terreros-Roncal J et al. Adult hippocampal neurogenesis is abundant in neurologically healthy subjects and drops sharply in patients with Alzheimer’s disease. Nat Med. 2019; 25: 554-560.
- ↑Nurk S, Koren S, Rhie A et al. The complete sequence of a human genome. Science. 2022; 376: 44-53.
- ↑Ciobanu LG, Sachdev P, Trollor JN. Differential gene expression in brain and peripheral tissues in depression across the life span: a review of replicated findings. Neurosci Biobehav Rev. 2016; 71: 281-293.
- ↑Ribot A. Diseases of the memory: an essay in the positive psychology. New York: Appleton; 1882.
- ↑Douaud G, Groves AR, Tamnes CK. A common brain network links development, aging, and vulnerability to disease. Proc Natl Acad Sci USA. 2014; 111: 17648-17653.
- ↑Hainmueller T, Bartos M. Dentate gyrus circuits for encoding, retrieval and discrimination of episodic memories. Nat Rev Neurosci. 2020; 21: 153-168.
- ↑Rodríguez-Matellán A, Alcázar N, Hernández F, Serrano M, Ávila J. In vivo reprogramming ameliorates aging features in dentate gyrus cells and improves memory in mice. Stem Cell Reports. 2020; 15: 1056-1066.
- ↑Weingarten MD, Lockwood AH, Hwo SY, Kirschner MW. A protein factor essential for microtubule assembly. Proc Natl Acad Sci USA. 1975; 72: 1858-1862.
- ↑Ávila J, Lucas JJ, Pérez M, Hernández F. Role of Tau protein in both physiological and pathological conditions. Physiol Rev. 2004; 84: 361-384.
- ↑Hernández F, Ávila J. Tauopathies. Cell Mol Life Sci. 2007; 64: 2219-2233.
- ↑Sato C, Barthelemy NR. Mawuenyega KG. Tau kinetics in neurons and the human central nervous system. Neuron. 2018; 97: 1284-1298 e7.
- ↑Ávila J. Tau phosphorylation and aggregation in Alzheimer’s disease pathology. FEBS Lett. 2006; 580: 2922-2927.
- ↑García-Escudero V, Ruiz-Gabarre D, Gargini R et al. A new non-aggregative splicing isoform of human Tau is decreased in Alzheimer’s disease. Acta Neuropathol. 2021; 142: 159-177.
- ↑Lucas JJ, Hernández F, Gómez-Ramos P, Morán MA, Hen R, Ávila J. Decreased nuclear beta-catenin, Tau hyperphosphorylation and neurodegeneration in GSK-3beta conditional transgenic mice. EMBO J. 2001; 20(1-2): 27-39.
- ↑Shi Y, Zhang W, Yang Y et al. Structure-based classification of tauopathies. Nature. 2021; 598: 359-363.
- ↑Gil L, Federico C, Pinedo F et al. Aging dependent effect of nuclear Tau. Brain Res. 2017; 1677: 129-137.
- ↑Mansuroglu Z, Benhelli-Mokrani H, Marcato V et al. Loss of Tau protein affects the structure, transcription and repair of neuronal pericentromeric heterochromatin. Sci Rep. 2016; 6: 33047.
- ↑Guo C, Jeong HH, Hsieh YC et al. Tau activates transposable elements in Alzheimer’s disease. Cell Rep. 2018; 23: 2874-2880.
- ↑Ramírez P, Zuniga G, Sun W et al. Pathogenic Tau accelerates aging-associated activation of transposable elements in the mouse central nervous system. Prog Neurobiol. 2022; 208: 102181.
- ↑Sun W, Samimi H, Gámez M, Zare H, Frost B. Pathogenic Tau-induced piRNA depletion promotes neuronal death through transposable element dysregulation in neurodegenerative tauopathies. Nat Neurosci. 2018; 21: 1038-1048.
- ↑Kane AE, Sinclair DA. Epigenetic changes during aging and their reprogramming potential. Crit Rev Biochem Mol Biol. 2019; 54: 61-83.
- ↑Tsai CC, Su PF, Huang YF, Yew TL, Hung SC. Oct4 and Nanog directly regulate Dnmt1 to maintain self-renewal and undifferentiated state in mesenchymal stem cells. Mol Cell. 2012; 47(2): 169-182.
- ↑Hou P, Li Y, Zhang X et al. Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds. Science. 2013; 341: 651-654.
- ↑Wang X, Wu J, Wang W et al. Reprogramming of rat fibroblasts into induced neurons by small-molecule compounds in vitro and in vivo. ACS Chem Neurosci. 2022; 13(14): 2099-2109.
- ↑Pallas-Bazarra N, Jurado-Arjona J, Navarrete M et al. Novel function of Tau in regulating the effects of external stimuli on adult hippocampal neurogenesis. EMBO J. 2016; 35: 1417-1436.
- ↑Lacomme M, Hales SC, Brown TW et al. Numb regulates Tau levels and prevents neurodegeneration in tauopathy mouse models. Sci Adv. 2022; 8: eabm4295.
Jesús Avila
CL Nicolás Cabrera, 1 · 28049 Madrid, España
Tlf.:+34 91 196 45 64 | E-Mail: javila@cbm.csic.es
Enviado: 14.11.22
Revisado: 26.11.22
Aceptado: 13.12.22


