IMPLICACIÓN DEL INFLAMASOMA NLRP3 EN SEPSIS
IMPLICATION OF THE NLRP3 INFLAMMASOME IN SEPSIS
Pablo Pelegrín
Instituto Murciano de Investigaciones Biosanitarias (IMIB-Arrixaca), Hospital Universitario Virgen de la Arrixaca, Murcia, España
Departamento de Bioquímica y Biología Molecular B, Facultad de Medicina, Universidad de Murcia, Murcia, España
La respuesta inflamatoria es uno de los principales mecanismos efectores del sistema inmunitario innato coordinado por una serie de receptores y señales solubles, entre los que se encuentran los receptores de reconocimiento de patrones y las citoquinas. La inflamación se desencadena tras la activación de dichos receptores en células inmunitarias innatas tras el reconocimiento de moléculas presentes en patógenos o de moléculas liberadas en los procesos de muerte celular, y coordina una respuesta que culmina en la eliminación del patógeno o en la reparación tisular. La desregulación de la respuesta inflamatoria puede desencadenar su cronificación y el desarrollo de enfermedades inflamatorias crónicas, metabólicas o degenerativas. El inflamasoma se forma por un receptor intracelular del tipo de reconocimiento de patrones y entre los distintos inflamasomas, el formado por el receptor NLRP3, es el principal que se activa en respuesta a señales de patógenos o del hospedador. Además, determinadas mutaciones ganancia-de-función en el gen NLRP3 se asocian a síndromes autoinflamatorios. La activación del inflamasoma NLRP3 conlleva una serie de pasos de oligomerización que culminan con la activación de caspasa-1 (Figura 1).

Esta caspasa procesa y activa distintas pro-citoquinas de la familia de la interleuquina (IL)-1. Además, caspasa-1 procesa la proteína gasdermina D, cuyo extremo amino-terminal escindido homooligomeriza y formar poros en la membrana plasmática por los que se liberan las citoquinas IL-1β e IL-18 de la célula. La membrana plasmática que contiene estos poros puede repararse, pero si la estimulación de caspasa-1 continúa en el tiempo, la membrana termina destruyéndose por la entrada de agua incontrolada a la célula, resultando en un tipo de muerte celular necrótica denominada piroptosis. La piroptosis también libera otro contenido intracelular, incluyendo oligómeros de inflamasoma y ADN mitocondrial que contribuirán a la propagación de la respuesta inflamatoria.
La sepsis se caracteriza por ser un síndrome de respuesta inflamatoria sistémica inducida por una infección y es la principal causa de muerte en las unidades de cuidados intensivos de los hospitales. El inflamasoma NLRP3 participa en la respuesta inflamatoria en sepsis y se ha descrito que ratones deficientes en NLRP3, así como ratones tratados con inhibidores de NLRP3, presentan una mayor supervivencia en modelos de sepsis. No obstante, en clínica los pacientes con sepsis desarrollan un estado inmunosupresor tras la respuesta inflamatoria, y es debido a ese estado inmunosupresor y las complicaciones causadas por infecciones secundarias, las que comprometen la viabilidad de los pacientes. Por tanto, el manejo clínico de los pacientes con sepsis es complicado y a día de hoy no existe un marcador pronostico que discrimine de forma temprana aquellos pacientes que vayan a desarrollar complicaciones. La activación NLRP3 en muestras de sangre de pacientes sépticos a tiempos tempranos resulto en la estratificación de dichos pacientes, al haber un grupo con una deficiencia en su activación. Este grupo tuvo más complicaciones y acumuló la mayoría de muertes, sugiriendo que la determinación del grado de activación del inflamasoma NLRP3 podría constituir un marcador temprano para poder pronosticar la evolución de los pacientes sépticos.
Agradecimientos:Este trabajo ha sido financiado por proyectos de investigación de FEDER/Ministerio de Ciencia, Innovación y Universidades-Agencia Estatal de Investigación (SAF2017-88276-R; PID2020-116709RB-I00), Fundación Séneca (20859/PI/18, 21081/PDC/19 y 00003/COVI/20), Instituto de Salud Carlos III (DTS21/00080), Comisión Europea H2020-SC1-2020-Single-Stage-RTD (965196 – PlasticHeal) y del European Research Council (ERC-2013-CoG 614578 y ERC-2019-PoC 899636).
The inflammatory response is a main effector mechanism of the innate immune system and it is coordinated by a signalling network triggered by different receptors and soluble factors, among them the pattern recognition receptors and cytokines play a central role. Inflammation coordinate the elimination of pathogens and initiate the regeneration of tissues and therefore is triggered by the engagement of these receptors in innate immune cells by ligand molecules from pathogens or necrotic cells. Dysregulation of the inflammatory response may lead to cornification and the development of chronic inflammatory, metabolic or degenerative diseases. The inflammasome is formed by an intracellular receptor of the pattern recognition family and among the different inflammasomes, the NLRP3 inflammasome, is the main that recognise pathogen- and host-derived signals. Gain-of-function mutations in NLRP3 gene are associated to auto-inflammatory syndromes. The activation of the NLRP3 inflammasome follows a series of oligomerization steps that culminate with the activation of caspase-1 (Figure 1). This caspase is able to process different pro-cytokines of the interleukin (IL)-1 family to their active forms, such as IL-1β and IL-18. Also, caspase-1 process the protein gasdermin D, and its amino-terminal fragment oligomerize and form pores in the plasma membrane that are a release pathway for IL-1β and IL-18. The pores formed by gasdermin D in the plasma membrane could be repaired, but if caspase-1 activation prolongs in the time, the cell swells by massive water intake and results in a type of inflammatory type of necrosis cell death called pyroptosis. Pyroptosis also results in the release of other intracellular content, as inflammasome oligomers and mitochondrial DNA that contributes to the propagation of the inflammatory response.

Sepsis is a systemic inflammatory response syndrome induced by an infection and constitute the main cause of deaths in the critical care units of the hospitals. The NLRP3 inflammasome participate in the inflammatory response in sepsis, and knock-out mice for NLRP3 or mice treated with specific NLRP3 inhibitors present an increased survival in sepsis models. However, in clinics septic patients develop an immunosuppression state after the inflammatory response that is the causative of secondary infections and complications that compromise the survival of septic patients. Therefore, the clinical management of septic patients is complex and up to date, there is any available prognostic marker to early discriminate septic patients that will develop future complications. The activation of the NLRP3 inflammasome in blood samples from septic patients at early time-points was able to stratify these patients, with a group presenting a defect in its activation. This septic patient group presented more complications and accumulated the majority of deaths, suggesting that the determination of the activation level of NLRP3 inflammasome could constitute a promising early prognostic marker to evaluate the evolution of the septic patients.
Acknowledgements This work was supported by grants to P.P. from FEDER/Ministerio de Ciencia, Innovación y Universidades-Agencia Estatal de Investigación (grant SAF2017-88276-R; PID2020-116709RB-I00), Fundación Séneca (grants 20859/PI/18, 21081/PDC/19 and 0003/COVI/20), Instituto de Salud Carlos III (DTS21/00080), European Commission H2020-SC1-2020-Single-Stage-RTD (965196 – PlasticHeal) and European Research Council (grants ERC-2013-CoG 614578 and ERC-2019-PoC 899636).
ACTIVACIÓN Y REGULACIÓN DEL INFLAMASOMA NLRP3 CON MUTACIONES PRESENTES EN EL SÍNDROME PERIÓDICO ASOCIADO A CRIOPIRINA
ACTIVATION AND REGULATION OF THE NLRP3 INFLAMMASOME WITH MUTATIONS LINKED TO CRYOPYRIN ASSOCIATED PERIODIC SYNDROMES
Cristina Molina-López1, Diego Angosto-Bazarra1, Ana Tapia-Abellán1, Laura Hurtado-Navarro1, Pablo Pelegrín1,2
1 Instituto Murciano de Investigaciones Biosanitarias (IMIB-Arrixaca), Hospital Universitario Virgen de la Arrixaca, Murcia, España
2 Departamento de Bioquímica, Biología Molecular B e Inmunología, Facultad de Medicina, Universidad de Murcia, Murcia, España
Los síndromes periódicos asociados a criopirina (CAPS) son una serie de condiciones hereditarias que debutan temprano con auto-inflamación producida por distintas mutaciones de ganancia-de-función (GdF) en el gen NLRP3, originando una activación del inflamasoma NLRP3 y sobreproducción de las citoquinas pro-inflamatorias IL-1β e IL-18.
La activación del inflamasoma NLRP3 silvestre se induce por señales endógenas de daño tisular o exógenas asociadas a patógenos. Este inflamasoma está formado por la proteína NLRP3, la proteína adaptadora ASC y la enzima efectora pro-casapasa-1. Al formarse el inflamasoma, la pro-casapasa-1 se activa y escinde IL-1β e IL-18 a su forma madura. También procesa la proteína gasdermina D (GSDMD), cuyo extremo amino-terminal forma poros en la membrana plasmática, induciendo la liberación de contenido intracelular y originando una muerte celular denominada piroptosis. Sin embargo, el mecanismo de activación y regulación del inflamasoma NLRP3 con mutaciones GdF está poco estudiado. En este trabajo estudiamos cómo la proteína NLRP3 con mutaciones GdF se activa en condiciones libre de patógenos en pacientes con CAPS, cómo el MCC950 (un inhibidor específico de NLRP3) puede inhibir esta activación, qué moléculas además de IL-1β e IL-18 se liberan aguas abajo de la activación del inflamasoma mutante y, cómo se regula post-traduccionalmente el inflamasoma NLRP3 con mutaciones GdF.
Este trabajo ha empleado macrófagos inmortalizados de ratón deficientes en Nlrp3 con un sistema inducible Tet-ON para expresar varios NLRP3 humano con mutaciones GdF presentes en pacientes con CAPS que se compararon con macrófagos transducidos con un vector vacío o un vector que expresa NLRP3 silvestre. Sangre de pacientes con CAPS se empleó para estudiar la producción de IL-1β y la formación de oligómeros de ASC como indicador de activación de NLRP3. Las células fueron tratadas con LPS, Pam3CSK4, IL-6, S100A9, IL-1α, TNF-α, palmitato, ATP o cristales de ácido úrico a diferentes concentraciones y tiempos en ausencia o presencia de MCC950 o de distintos inhibidores de deubiquitinasas. El comité de ética clínica aprobó este estudio.
A diferencia de la expresión de NLRP3 silvestre, la expresión de NLRP3 con mutaciones GdF resulta en una activación del inflamasoma y consecuentemente de caspasa-1 y el posterior procesamiento de GSDMD, seguido de la liberación de ciertas proteínas celulares como IL-18, P2X7 y LDH. Por otra parte, solo se observó liberación de IL-1β tras el tratamiento con LPS, Pam3CSK4, IL-6, palmitato y S100A9, ya que activan a NF-κB y la expresión del gen de la Il1b. El inhibidor MCC950 confirmó la implicación de NLRP3 al bloquear la liberación de IL-1β, IL-18, HMBG1, IL-1α, P2X7, cistatina B y anexina-1, pero no de TNF-α. Distintos inhibidores de deubiquitinasa fueron capaces de reducir la activación de NLRP3 con mutaciones GdF al reducir el procesamiento de GSDMD y la liberación de IL-1β.
Las mutaciones de GdF en NLRP3 inducen una activación basal del inflamasoma respecto a NLRP3 silvestre, y aunque esta activación está estrechamente ligada al nivel de expresión, su activación se puede regular e incrementar en respuesta a diferentes señales endógenas (como son IL-6, palmitato o S100A9) y además post-traduccionalmente por la de-ubiquitinación.
Agradecimientos: Este trabajo ha sido financiado por proyectos de investigación de FEDER/Ministerio de Ciencia, Innovación y Universidades-Agencia Estatal de Investigación (SAF2017-88276-R; PID2020-116709RB-I00), Fundación Séneca (20859/PI/18, 21081/PDC/19 y 00003/COVI/20), Instituto de Salud Carlos III (DTS21/00080), Comisión Europea H2020-SC1-2020-Single-Stage-RTD (965196 – PlasticHeal) y del European Research Council (ERC-2013-CoG 614578 y ERC-2019-PoC 899636). Laura Hurtado-Navarro tiene una beca de la Fundación Séneca (Región de Murcia, Spain) 21214/FPI/19. Cristina Molina-López tiene una beca de Ministerio de Ciencia, Innovación y Universidades-Agencia Estatal de Investigación (PRE2018-087063).
Cryopyrin-associated periodic syndromes (CAPS) are a group of hereditary auto-inflammatory disorders that result from the gain-of-function mutations in the NLRP3 gene, resulting in the autoactivation of the NLRP3 inflammasome and the overproduction of the proinflammatory cytokines IL-1β and IL-18. For wild-type NLRP3, different pathogen and host-related signals are required to activate the NLRP3 inflammasome, which is formed by NLPR3, the adaptor protein ASC and the effector enzyme pro-caspase-1. Once the inflammasome is formed, pro-caspase-1 is activated and cleaves pro-IL-1β and pro-IL-18 to their active forms and gasdermin D which then its N-terminal fragment form pores in the plasma membrane, through where IL-1β, IL-18 and intracellular content are released. Gasdermin D pores then drives a specific type of cell death called pyroptosis. However, the activation and regulation mechanism of mutant NLRP3 is still poorly known.
Questions such as how the activity of mutated NLRP3 is regulated in sterile conditions in patients; whether MCC950 (a specific inhibitor of NLRP3) is able to inhibit this activation; what molecules besides IL-1β and IL-18 are implicated downstream the activation pathway; and how NLRP3 mutant is regulated at post-translational level are still unknown.
Nlrp3-deficient immortalized mouse macrophages with a Tet-ON inducible system were used to express several NLRP3 variants with mutations present in CAPS patients and compared to macrophages transduced with empty vector or with wild-type NLRP3. CAPS patient blood was used to study IL-1β production and formation of ASC oligomers as readouts of NLRP3 activation. Cells were treated with LPS, Pam3CSK4, IL-6, S100A9, IL-1α, TNF-α, palmitate, ATP, or uric acid crystals at different concentrations and times in the absence or presence of MCC950 or with different de-ubiquitinase inhibitors. The clinical ethics committee of the Clinical University Hospital Virgen de la Arrixaca (Murcia) approved this study.
Contrasting with the expression of wild-type NLRP3, the sole expression of mutant NLRP3 results in a constitutive activation of the inflammasome with the activation of caspase-1 and gasdermin D cleavage, followed by the release of several cellular proteins as IL-18, P2X7 or LDH. IL-1β release was only observed after LPS, Pam3CSK4, IL-6, palmitate and S100A9 treatment, compounds that activate NF-κB and the subsequent expression of Il1b gene. MCC950 was able to block the release of IL-1β, IL-18, HMGB1, IL-1α, P2X7, cystatin B, annexin-1 but not TNF-α, confirming NLRP3 activation. Deubiquitinase inhibitors were able to reduce NLRP3 activation and IL-1β release when mutant NLRP3 was expressed, suggesting that ubiquitination of mutant NLRP3 restrict its activity.
Gain-of-function NLRP3 mutations present a basal activation with respect to wild-type NLPR3, and its activation tightly depends on its expression levels, but could be further increased by different endogenous host-derived signals, such as IL-6, palmitate or S100A9 proteins. Additionally, mutated auto-active NLRP3 is post-translational regulated by ubiquitination, that impairs its auto-activation. This study shed new light into the origins of non-infectious inflammatory flares in CAPS patients.
Acknowledgements: This work was supported by grants to P.P. from FEDER/Ministerio de Ciencia, Innovación y Universidades-Agencia Estatal de Investigación (grant SAF2017-88276-R; PID2020-116709RB-I00), Fundación Séneca (grants 20859/PI/18, 21081/PDC/19 and 0003/COVI/20), Instituto de Salud Carlos III (DTS21/00080), European Commission H2020-SC1-2020-Single-Stage-RTD (965196 – PlasticHeal) and European Research Council (grants ERC-2013-CoG 614578 and ERC-2019-PoC 899636). Laura Hurtado-Navarro was supported by the fellowship 21214/FPI/19 (Fundación Séneca, Región de Murcia, Spain). Cristina Molina-López was supported by the fellowship PRE2018-087063 (Ministerio de Ciencia, Innovación y Universidades-Agencia Estatal de Investigación, Spain).
ACTIVACIÓN DE LOS INFLAMASOMAS PIRINA Y NLRP3 DURANTE LA SEPSIS
ACTIVATION OF THE PYRIN AND NLRP3 INFLAMMASOMES DURING SEPSIS
Laura Hurtado-Navarro1, Laura Martínez-Alarcón1, Graciela Valero-Navarro1,2, Carlos García-Palenciano1,3, Pablo Pelegrín1,4
1 Instituto Murciano de Investigaciones Biosanitarias (IMIB-Arrixaca), Hospital Universitario Virgen de la Arrixaca, Murcia, España
2 Servicio de Cirugía General, Hospital Universitario JM Morales Meseguer, Murcia, España
3 Servicio de Anestesiología y Reanimación, Hospital Clínico Universitario Virgen de la Arrixaca, Murcia, España
⁴ Departamento de Bioquímica y Biología Molecular B, Facultad de Medicina, Universidad de Murcia, Murcia, España
La sepsis es una de las principales causas de muerte en las unidades de cuidados intensivos y se define como una respuesta inflamatoria sistémica seguida por un estado de inmunosupresión. Se conoce que el inflamasoma NLRP3 participa en dicho proceso, sin embargo, el papel de otros inflamasomas, como Pirina, no está totalmente caracterizado.
Se recogieron muestras de 20 individuos con una sepsis de origen intraabdominal, 19 individuos sometidos a una cirugía abdominal que no desarrollaron sepsis y 29 controles sanos. El Comité de Ética del Hospital Clínico Universitario Virgen de la Arrixaca (Murcia) aprobó este estudio y sus procedimientos. El inflamasoma NLRP3 se estimuló en sangre completa con LPS+ATP y el inflamasoma Pirina con LPS+TcdB. La determinación de oligómeros de ASC en monocitos (CD14+CD16+CD15–) se realizó por citometría de flujo y la determinación de citoquinas por ELISA. Se evaluaron parámetros clínicos, hematológicos y bioquímicos de todos los pacientes.
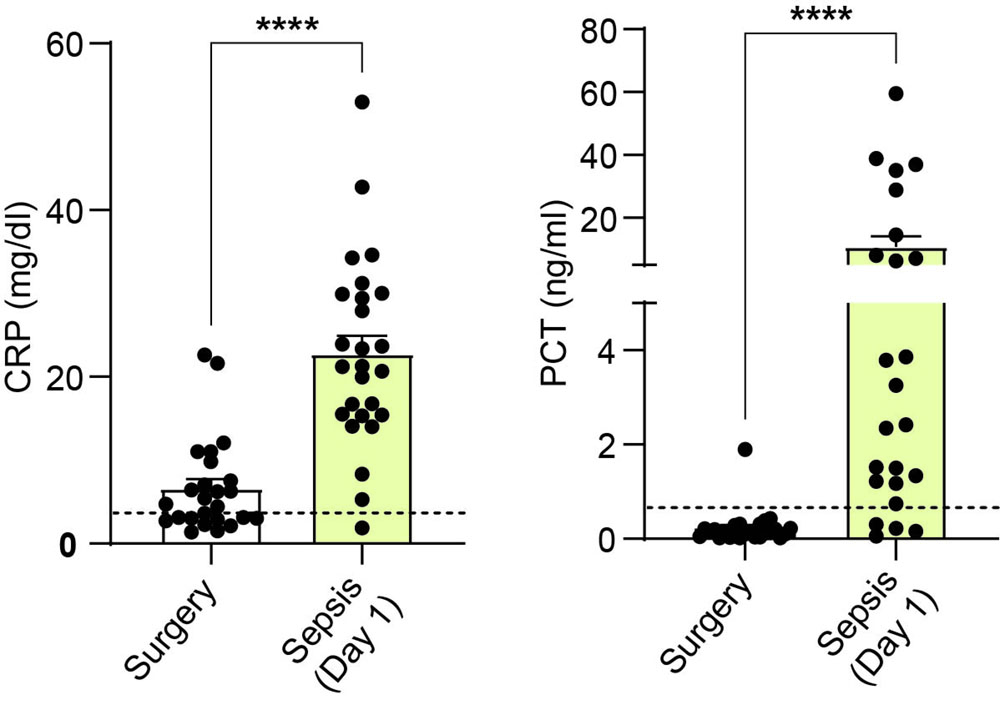
A las 24h del inicio del episodio séptico, los pacientes presentaban marcadores de inflamación sistémica como PCR y PCT elevados en plasma (Figura 1). La liberación de IL-1β en las muestras de sangre y la formación de oligómeros de ASC en monocitos tras la estimulación de NLRP3 resultó en una respuesta diferencial entre los pacientes sépticos, identificando entre ellos un grupo de 10 individuos con una respuesta inmunocomprometida del inflamasoma NLRP3 y 4 individuos con una respuesta normal del mismo (Figura 2A). Sin embargo, todos los individuos estudiados presentaron una respuesta normal cuando se activaba el inflamasoma Pirina (Figura 2B).
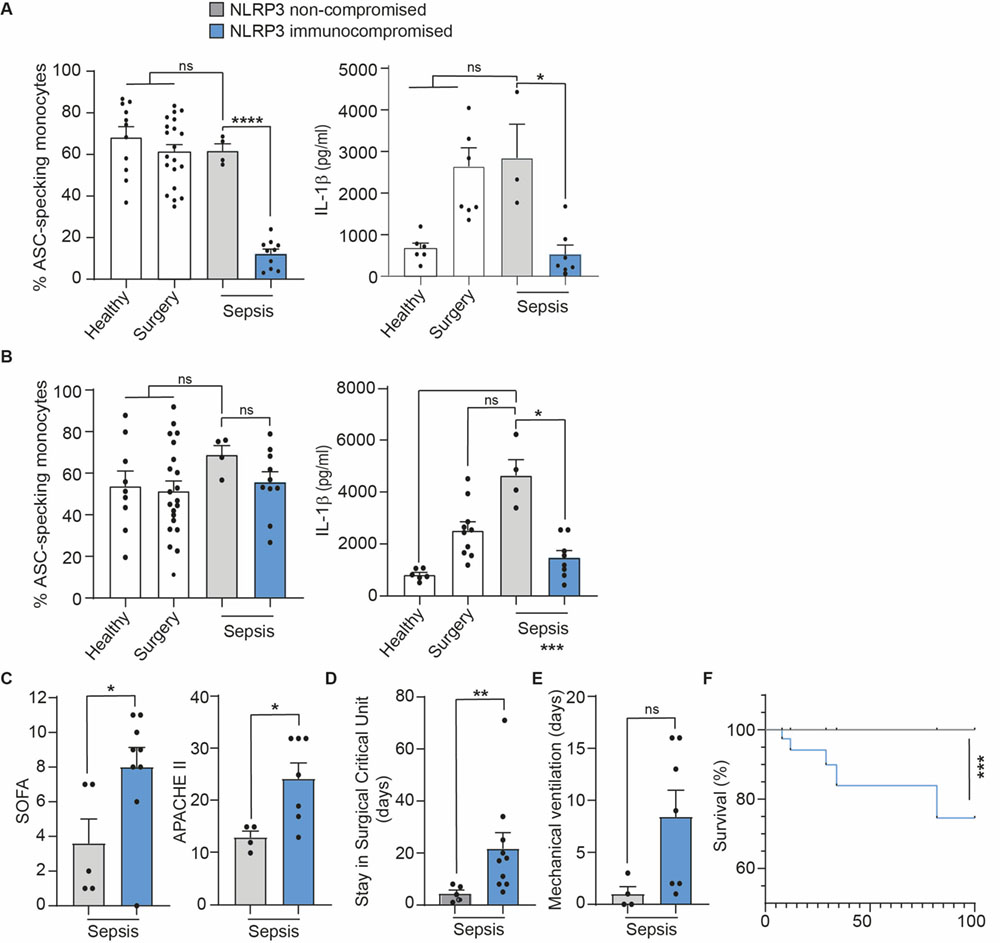
Los pacientes inmunocomprometidos para NLRP3 presentaron elevados distintos parámetros de severidad, tanto bioquímicos como clínicos, como las escalas SOFA y APACHEII, así como un peor pronóstico al necesitar más días en la unidad de cuidados intensivos, días con ventilación mecánica y elevada mortalidad (Figura 2).
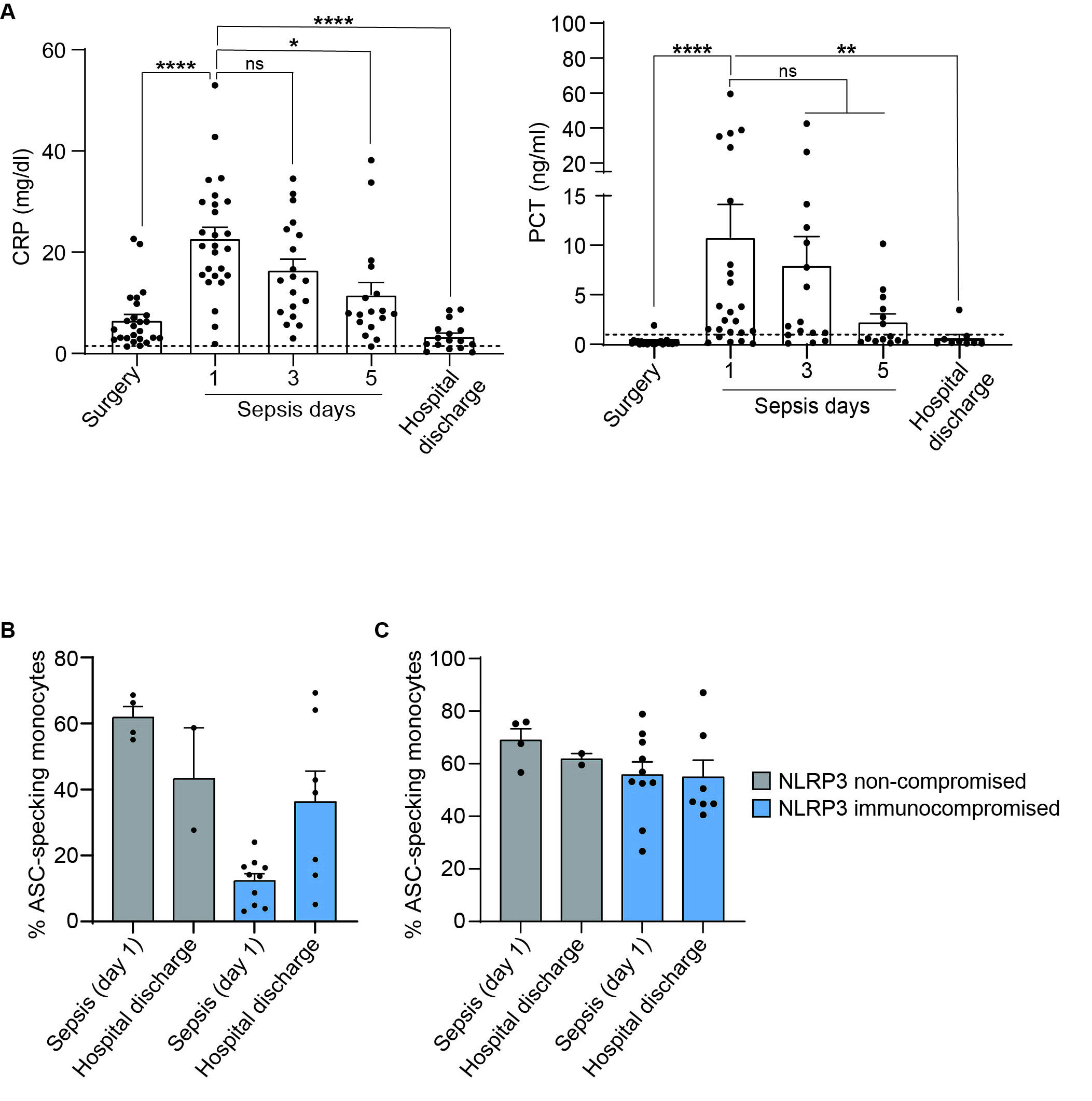
La concentración de PCR y PCT en plasma disminuyó después de 3 y 5 días del episodio séptico en todos los pacientes, indicando una resolución gradual de la inflamación sistémica. En el alta hospitalaria, aquellos pacientes inmunocomprometidos para NLRP3 que sobrevivieron y se recuperaron, presentaron una mejora en la respuesta del inflamasoma NLRP3. Esto sugiere que la alteración en la respuesta del inflamasoma NLRP3 es un estado transitorio durante el episodio séptico (Figura 3).
Nuestro estudio confirma que durante la fase inflamatoria inicial de la sepsis existe una respuesta diferencial del inflamasoma NLRP3 en los pacientes sépticos. Por otra parte, la respuesta del inflamasoma Pirina fue similar en todos los pacientes, lo que indica que este inflamasoma presenta unos mecanismos regulatorios diferentes durante la sepsis. Por tanto, la inhibición del inflamasoma NLRP3 durante la sepsis podría considerarse un indicador temprano de inmunosupresión en pacientes críticos, mientras que el inflamasoma Pirina emerge como un control positivo de la respuesta inflamatoria a este proceso. Además, la recuperación de la respuesta del inflamasoma NLRP3 en monocitos podría considerarse un indicador de la recuperación de la respuesta inmunitaria en los pacientes sépticos.
Agradecimientos: Este trabajo ha sido financiado por proyectos de investigación de FEDER/Ministerio de Ciencia, Innovación y Universidades-Agencia Estatal de Investigación (SAF2017-88276-R; PID2020-116709RB-I00), Fundación Séneca (20859/PI/18, 21081/PDC/19 y 00003/COVI/20), Instituto de Salud Carlos III (DTS21/00080), Comisión Europea H2020-SC1-2020-Single-Stage-RTD (965196 – PlasticHeal) y del European Research Council (ERC-2013-CoG 614578 y ERC-2019-PoC 899636). Laura Hurtado-Navarro tiene una beca de la Fundación Séneca (Región de Murcia, Spain) 21214/FPI/19.
Sepsis is the leading cause of death in critical care units and it is defined by a systemic inflammatory response which is followed with an immunosuppression of the host. While the function of the NLRP3 inflammasome is involved in sepsis, the function of other inflammasomes, like the Pyrin inflammasome, is not well known.
Individuals with intra-abdominal origin sepsis (n=20), abdominal surgery individuals that had not developed sepsis (n=19), and a healthy control group (n=29) were recruited. The clinical ethics committee of the Clinical University Hospital Virgen de la Arrixaca (Murcia, Spain) approved this study and its procedures. NLRP3 inflammasome was stimulated in whole blood by LPS+ATP and Pyrin inflammasome with LPS+TcdB. Flow cytometry was used to determine the formation of ASC specks formation in monocytes (CD14+CD16+CD15–) and ELISA to determine cytokine secretion. The evolution of clinical parameters, haematological features and plasma biochemistry parameters were evaluated.
Systemic inflammatory markers like CRP or PCT were elevated in septic patients’ plasma 24h after sepsis initiation when compared to the control groups (Figure 1), indicating an inflammatory state of the septic patients. The release of IL-1β in whole blood samples and the formation of ASC specks in monocytes after NLRP3 stimulation resulted in a differential response among septic patients, identifying a group of 10 individuals with an impaired NLRP3 inflammasome activation and 4 individuals with a normal response of the NLRP3 inflammasome (Figure 2A). However, all septic patients presented a non-impaired activation of the Pyrin inflammasome (Figure 2B).


Septic patients with impaired NLRP3 inflammasome had biochemical and clinical scores of disease severity above the average. Specifically, SOFA and APACHEII were higher at admission in the group with NLRP3 inflammasome impairment (Figure 2), and these individuals also present worst disease progression measured as days in the critical care unit, days with mechanical ventilation and mortality (Figure 2).
Plasma concentration of CRP and PCT decreased after 3 and 5 days of sepsis onset in all septic patients, indicating a gradual resolution of systemic inflammation (Figure 3A). At hospital discharge, NLRP3-immunocompromised septic patients who survived and recovered from sepsis had an improvement on NLRP3 activation. Non-compromised NLRP3 septic patients had normal ASC-speck formation during the course of sepsis (Figure 3B-C). This suggests that NLRP3 inflammasome impairment during sepsis is a transitory state.

Our study confirms that during the initial inflammatory response in sepsis there is a differential response of the NLRP3 inflammasome in septic patients. The identification of NLRP3-immunocompromised septic patients was optimized in a whole blood assay and accounted for most late deaths and have the worse prognosis. Whereas, the Pyrin inflammasome response was similar in patients and suggests that Pyrin inflammasome present different regulation mechanisms inflammasome during sepsis.
The impairment of the NLRP3 inflammasome in septic patients might serve as an early indication of immunosuppression in critical patients, while the Pyrin inflammasome emerge as a positive control of inflammasome activation. Moreover, restoration of NLRP3 inflammasome activation in monocytes could be a good indicator of immune recovery in septic patients.
Acknowledgements: This work was supported by grants to P.P. from FEDER/Ministerio de Ciencia, Innovación y Universidades-Agencia Estatal de Investigación (grant SAF2017-88276-R; PID2020-116709RB-I00), Fundación Séneca (grants 20859/PI/18, 21081/PDC/19 and 0003/COVI/20), Instituto de Salud Carlos III (DTS21/00080), European Commission H2020-SC1-2020-Single-Stage-RTD (965196 – PlasticHeal) and European Research Council (grants ERC-2013-CoG 614578 and ERC-2019-PoC 899636). Laura Hurtado-Navarro was supported by the fellowship 21214/FPI/19 (Fundación Séneca, Región de Murcia, Spain).
