REGULACIÓN DEL INFLAMASOMA EN SÍNDROMES AUTOINFLAMATORIOS
Cristina Molina López1, Pablo Pelegrín1,2
1. Instituto Murciano de Investigación Biosanitaria (IMIB), Murcia
2. Departamento de Bioquímica y Biología Molecular B e Inmunología, Facultad de Medicina, Universidad de Murcia, Murcia
Los Síndromes Periódicos Asociados a la Criopirina (CAPS) son un conjunto de afecciones autoinflamatorias consecuencia de variantes monoalélicas en el gen NLRP3 que exacerban la producción de IL-1beta. Los síndromes CAPS engloban tres fenotipos clínicos diferentes de gravedad creciente: el síndrome autoinflamatorio familiar inducido por frío (FCAS) como forma más leve, el síndrome de Muckle-Wells (MWS) como fenotipo intermedio, y la enfermedad inflamatoria multisistémica de inicio neonatal/síndrome neurológico cutáneo articular infantil crónico (NOMID/CINCA) como fenotipo más grave. Por lo general, estos fenotipos comienzan de forma temprana en la vida y se caracterizan por episodios recurrentes con fiebre, erupción cutánea similar a la urticaria, conjuntivitis e inflamación articular.
Las variantes en el gen NLRP3 asociadas a los síndromes CAPS son de ganancia de función, pero su mecanismo sobre la activación del inflammasoma aún no se conoce bien. Las variantes de NLRP3 asociadas a CAPS se consideran hipersensibles, induciendo un inflamasoma tras el cebado celular, pero los pacientes con CAPS y los modelos animales de esta enfermedad presentan brotes inflamatorios en ausencia de desencadenantes externos.
En este trabajo, se utilizaron muestras de sangre de pacientes CAPS y macrófagos modificados genéticamente que expresaban diferentes variantes de NLRP3 asociadas a CAPS para evaluar la función de NLRP3 disociada del cebado celular. Empleando estas herramientas hemos descubierto que las variantes de NLRP3 asociadas a CAPS dan lugar constitutivamente a inflamasomas activos, que inducen una escisión basal de gasdermina D, liberación de IL-18 y piroptosis. Este inflamasoma NLRP3 constitutivamente activo se puede bloquear por el inhibidor MCC950 y depende del nivel de expresión de NLRP3, siendo regulado además por la deubiquitinación.
También hemos descrito que la activación del factor de trascripción NF-kB con lipopolisacárido u otras moléculas endógenas derivadas del huésped (palmitato, S100A9 o IL-6) modula al alza la activación del inflamasoma NLRP3 asociado a síndromes CAPS y amplia el repertorio de moléculas secretadas por los macrófagos, identificando nuevas proteínas implicadas en la patogénesis CAPS. Además, los inflamasomas NLRP3 con variantes asociadas a síndromes CAPS afectaron al inmunometabolismo de las células mieloide, bloqueando la glucólisis. Estos resultados demuestran que las variantes de NLRP3 asociadas a CAPS forman un inflamasoma constitutivamente activo que induce piroptosis basal y liberación de IL-18 sin cebado celular, sugiriendo un mecanismo independiente del cebado para el inicio de los brotes de CAPS caracterizado además por una profunda afectación en el metabolismo de la célula.
EFECTO DE LOS NANOPLÁSTICOS SOBRE LA RESPUESTA INFLAMATORIA
Adrián Núñez-Sancho1, Diego Angosto-Bazarra1, Laura Martínez-Alarcón1,2,3, Pablo Pelegrín1,3
1. Instituto Murciano de Investigación Biosanitaria Pascual Parrilla, El Palmar, Murcia, España.
2. Hospital Clínico Universitario Virgen de la Arrixaca, El Palmar, Murcia, España.
3. Departamento de Bioquímica y Biología Molecular B e Inmunología, Facultad de Medicina, Universidad de Murcia, Murcia, España.
La mayoría de los productos plásticos son de un solo uso, por lo que muchos de ellos acaban acumulándose en el medio ambiente y degradándose a partículas de pequeño tamaño denominadas micro y nanoplásticos (MNPLs). Actualmente no hay mucha evidencia científica acerca de los posibles efectos perjudiciales que estos MNPLs pueden tener en la salud humana, y más concretamente en el sistema inmune y la respuesta inflamatoria. En este estudio, hemos investigado el efecto de dos nanoplásticos; poliestireno (PS) y tereftalato de polietileno (PET), en la respuesta inflamatoria en dos escenarios diferentes: i) hemos evaluado la respuesta inflamatoria tras una exposición previa a nanoplásticos. ii) Hemos estudiado si los nanoplásticos son capaces de inducir activación de inflamasoma tras un estado inflamatorio previo. En la primera aproximación, tras un tratamiento previo con diferentes concentraciones de partículas de poliestireno, se evaluaron los niveles de activación del inflamasoma NLRP3 y pirina, así como la liberación de IL-6 en macrófagos de ratón derivados de médula ósea (BMDMs) y en células mononucleares de sangre periférica humanas (PBMCs). En la segunda aproximación, los macrófagos de ratón y PBMCs humanas fueron cebadas con PAMPs (patrones moleculares asociados a patógenos) y tratadas con diferentes concentraciones de PS y PET para evaluar si estas partículas son capaces de producir activación de inflamasoma. Nuestros resultados muestran que una exposición previa a nanoplásticos reduce la expresión de diferentes genes inflamatorios, la liberación de IL-6 y la activación del inflamasoma NLRP3 y pirina de una manera dosis dependiente. Por otro lado, los nanoplásticos son capaces de inducir la activación del inflamasoma NLRP3 tanto en BMDMs de ratón con en PBMCs humanas que han sido cebadas previamente con PAMPs. Los nanoplásticos inducen la oligomerización de ASC así como la activación de caspasa 1 y gasdermina D lo que acaba produciendo la liberación de citoquinas inflamatorias como la IL-1beta y la IL-18. Nuestros datos muestran que los nanoplásticos se internalizan en los macrófagos y mediante la actividad de la catepsina B y una bajada del potasio intracelular se activa el inflamasoma NLRP3. En resumen, nuestro estudio muestra que los nanoplásticos pueden ser internalizados por las células inmunitarias innatas y tener un efecto en la producción y modulación de la respuesta inflamatoria.
LA EXPRESIÓN DEL RECEPTOR PURINÉRGICO P2X7 ESTÁ ELEVADA EN LINFOCITOS DE PACIENTES CON SEPSIS ABDOMINAL
Juan José Martínez García1,2, Helios Martínez Banaclocha1, Laura Martínez Alarcón1, Carlos García Palenciano3, Pablo Pelegrín1,2
1. Instituto Murciano de Investigación Biosanitaria (IMIB), Hospital Clínico Universitario Virgen de la Arrixaca, 30120 Murcia.
2. Departamento de Bioquímica y Biología Molecular B e Inmunología, Facultad de Medicina, Universidad de Murcia, Murcia
3. Unidad de Reanimación, Hospital Clínico Universitario Virgen de la Arrixaca, 30120 Murcia.
La sepsis se define como una respuesta inflamatoria sistémica causada por infecciones seguida por una fase de inmunosupresión. Esta disrupción del equilibrio homeostático en la respuesta inmune da lugar a un alto riesgo de mortalidad, siendo así la sepsis la principal causa de muerte en las unidades de cuidados intensivos de los hospitales. El receptor purinérgico P2X7 es importante para la activación de las células del sistema inmune, específicamente en las células mononucleares de sangre periférica, mediante el reconocimiento de ATP extracelular como señal de peligro. En este trabajo, se ha estudiado el porcentaje de células mononucleares de sangre periférica que expresan el receptor P2X7 en una cohorte de pacientes sépticos de origen abdominal 24 horas después de su ingreso. Hemos encontrado que, aunque los linfocitos T CD4 positivos es la única población de células que aumenta en sepsis en comparación con el resto de poblaciones de linfocitos, todas las poblaciones estudiadas (incluyendo linfocitos T CD8 positivos, células B y células Natural Killer) presentaron un aumento del porcentaje de células que expresan el receptor P2X7 en pacientes sépticos en comparación con los controles sanos y con los pacientes con cirugía abdominal que no desarrollaron sepsis.
El porcentaje de linfocitos que expresan P2X7 en sepsis se correlacionó positivamente con el aumento de los niveles de algunos marcadores de inflamación, como las interleuquinas 6 y 8 (IL-6 e IL-8), procalcitonina (PCT) o elevados niveles de expresión de P2X7 en monocitos. Sin embargo, se encontró una correlación negativa entre las proteínas de la fase aguda (PCT) y el porcentaje de linfocitos sobre el total de leucocitos mononucleados.
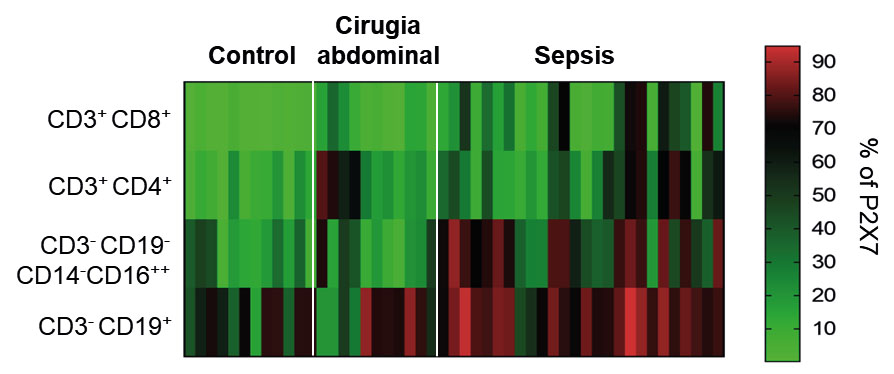
Además, se observó que el receptor P2X7 soluble en plasma de pacientes sépticos presenta una correlación positiva con la interleuquina 18 (IL-18), citoquina cuya liberación depende de la activación del inflamasoma NLRP3, pero que correlacionó negativamente con el ATP extracelular. Estos datos sugieren que, durante la sepsis, el receptor P2X7 aumenta su expresión en un alto porcentaje de linfocitos, que ahora serían capaces de reconocer el ATP extracelular como señal de peligro. Como P2X7 es un receptor citolítico, este evento podría estar asociado con una subsecuente muerte celular, y con elevados niveles de P2X7 soluble en plasma. Sin embargo, se requieren más estudios para dilucidar la función de P2X7 en estas células durante la sepsis.
